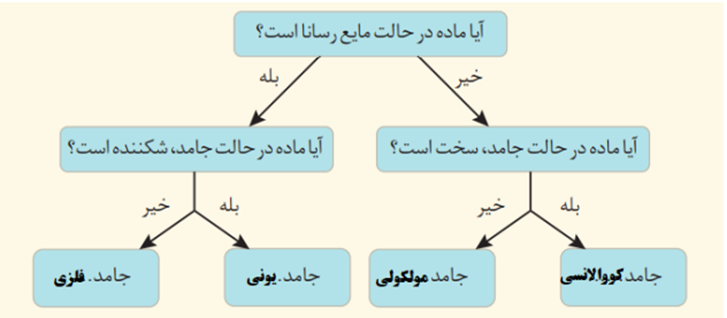
توجه:
شما با مطالعه این درسنامه می توانید به سوالات 881-900از کتاب نوروز و سوالات 81،450،451،621،779،932،1066،1088،1242از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
دانش آموزان عزیز سلام💕
در این مطلب نکات و سوالات مربوط به فصل سوم شیمی دوازدهم را بررسی می کنیم.
 | درسنامه شامل : خلاصه مطالب و نکات 5 تست کنکور سال های اخیر سوالات نهایی مربوطه |
ابتدا سوالات نهایی مربوطه را بررسی می کنیم.
هر چه تفاوت بین نقطه ذوب و جوش یک ماده خالص بیشتر باشد، نیرو های جاذبه میان ذره های سازنده آن (قوی تر/ ضعیف تر) است.
اگر نسبت بار به شعاع یون برابر باشد، شعاع این یون 70 پیکومتر است. نادرست
نقشه پتانسیل رو به رو مربوط به مولکول یک مایع است. توضیح دهید آیا با نزدیک کردن میله شیشه ای باردار به باریکه این مایع می توان آن را از راستای حرکت خود منحرف نمود؟
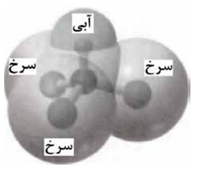
 برخی مواد سازنده نوعی خاک رس در زیر معرفی شده اند. با توجه به آنها به پرسش ها پاسخ دهید.
برخی مواد سازنده نوعی خاک رس در زیر معرفی شده اند. با توجه به آنها به پرسش ها پاسخ دهید.
آ) ساختار الماس مشابه کدام ترکیب است؟
ب) سرخ فام بودن این نوع خاک رس را به وجود کدام ماده نسبت می دهید؟
پ) نیرو های جاذبه بین ذره های سازنده کدام ماده کمتر است؟ چرا؟
هنگام پختن سفالینه های تهیه شده از این نوع خاک رس، درصد جرمی Na2O چه تغییری می کند؟ دلیل بنویسید.

با توجه به شکل به پرسش ها پاسخ دهید.
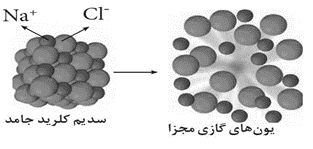
آ) این شکل چه فرایندی را نشان می دهد؟
ب) انرژی لازم برای انجام این واکنش چه نامیده می شود؟
پ) اگر به جای یون کلرید، یون برمید جایگزین شود، انرژی لازم برای انجام این واکنش کمتر یا بیشتر می شود؟ دلیل بنویسید.

درسنامه:
هر ترکیب یونی دوتایی را می توان فراوردۀ واکنش یک فلز با یک نافلز دانست.
پس از دادوستد الکترون و تشکیل یون ها، میان یون های ناهمنام، نیروی جاذبه و میان یون های همنام، نیروی دافعه پدید می آید.
این نیروها به شمار معینی از یون ها محدود نشده بلکه میان همۀ آنها و در فاصله های گوناگون وارد می شود.
نیروهای جاذبه میان یون های ناهمنام بر نیروهای دافعه میان یون های همنام غالب است. در نتیجه در شبکه بلوری ترکیب های یونی فاصله یون های همنام از فاصله یون های ناهمنام بیشتر است.
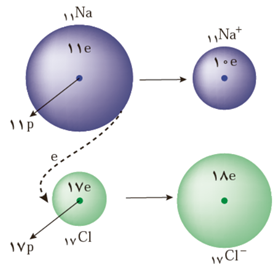
از واکنش فلز سدیم با گاز کلر، جامد یونی سفید رنگی بر جای می ماند که همان نمک خوراکی است، نور(زرد رنگ) و گرمای زیاد آزاد شده در این واکنش نشان می دهد که بسیار گرماده است.
شعاع: اتم سدیم > یون کلر > یون سدیم > اتم کلر
در شبکه بلور سدیم کلرید یون ها می توانند در راس ها و مرکز وجه های مکعب یا در مرکز مکعب و وسط اضلاع مکعب قرار داشته باشد.
برلیم (Be) و بور (B) هیچگاه پیوند یونی تشکیل نمی دهند زیرا یون های برلیم و بور ناپایدار بوده و در طبیعت تشکیل نمی شوند.
واژه شبکه بلوری برای توصیف آرایش سه بعدی و منظم اتم ها، مولکول ها و یون ها در حالت جامد به کار می رود.
فرمول شیمیایی هر ترکیب یونی، ساده ترین نسبت کاتیون ها و آنیون های سازندۀ آن را نشان می دهد.
به شمار نزدیکترین یون های ناهمنام موجود پیرامون هریون در شبكه بلور، عدد کوئوردیناسیون می گویند.

اغلب نمک ها به نسبت سخت و شکننده هستند.
ترکیبات یونی در حالت جامد رسانای جریان برق نیستند اما در حالت مذاب یا محلول رسانای جریان برق اند.
نقطه ذوب و جوش ترکیبات یونی بسیار بالا است هر چه نیروی جاذبه میان ذره های سازنده یک ماده خالص قوی تر باشد تفاوت بین نقطه ذوب و جوش آن بیشتر بوده و آن ماده در گستره دمایی بیشتری به حالت مایع باقی می ماند.
یکای اندازه گیری شعاع یونی و شعاع اتمی پیکومتر است.
شمار الکترون های مبادله شده در یک ترکیب یونی =
بار کاتیون × اندیس کاتیون = بار آنیون × اندیس آنیون
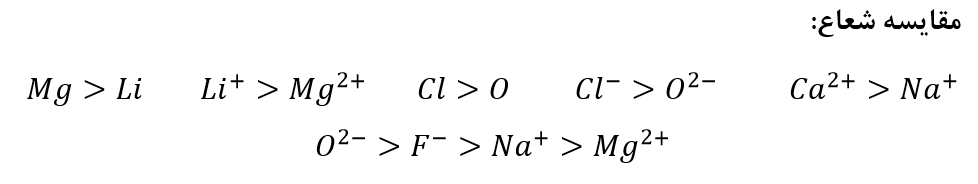
شعاع یون منفی > شعاع اتم خودش
شعاع یون مثبت < شعاع اتم خودش
(در یک دوره) شعاع یون های منفی >> شعاع یون های مثبت
در آنیون های یک دوره هر چه بار منفی یون بیشتر باشد شعاع یونی بزرگتر است.
در کاتیون های یک دوره هر چه بار مثبت بیشتر باشد شعاع یونی کوچکتر است.
در یک دوره بزرگترین شعاع یونی برای یون گروه 15 و کوچکترین شعاع یونی مربوط به یون گروه 13 است.
در یک گروه از بالا به پایین شعاع یونی افزایش می یابد.

برای مقایسه چگالی بار یون ها ابتدا به بار یون ها توجه می کنیم (تغییرات بار یون ها نسبت به شعاع معمولا شدیدتر است). و اگر بار یون ها با یکدیگر برابر بود به شعاع یون ها توجه می کنیم.
در یک گروه از بالا به پایین به دلیل ثابت بودن بار یون و افزایش شعاع آن چگالی بار یون ها کاهش می یابد.
اگر قدر مطلق بار یون یکسان باشد اما علامت بار الکتریکی آنها متفاوت باشد از آنجایی که شعاع یون های مثبت معمولا از شعاع یون های منفی کوچکتر است، چگالی بار آنها بیشتر است.
هر چه چگالی بار یک یون بیشتر باشد برهمکنش آن با یون های پیرامون بیشتر خواهد بود.
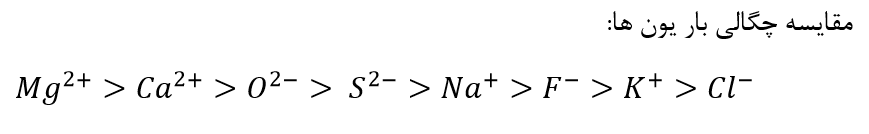
آنتالپی فروپاشی گرمای مصرف شده در فشار ثابت برای فروپاشی یک مول از شبکه یونی و تبدیل آن به یون های سازنده گازی است.
هر چه چگالی بار یون های سازنده یک جامد یونی کمتر باشد، شبکه آن آسان تر فروپاشیده می شود.
هر چه مجموع قدر مطلق بار یک آنیون و کاتیون بزرگتر باشد آنتالپی فروپاشی شبکه آن بزرگتر است.
اگر مجموع قدر مطلق بار یک کاتیون و آنیون برای دو ترکیب یونی مساوی باشد به شعاع یون ها توجه می کنیم. هر چه شعاع یون ها کوچکتر باشد چگالی بار آنها بیشتر است و آنتالپی فروپاشی آن بزگتر است.
با تقریب کلی می توان گفت هر چه انرژی شبکه بیشتر باشد نقطه ذوب و جوش ترکیب یونی بالاتر خواهد بود.
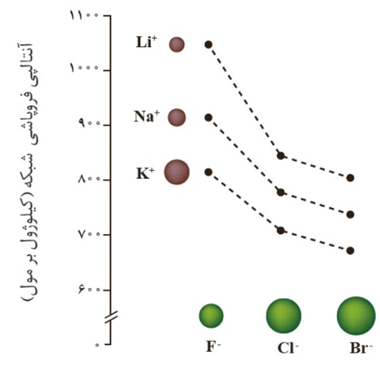
آنتالپی فروپاشی فلوئورید در یک فلز قلیایی معین به میزان قابل توجهی نسبت به آنتالپی فروپاشی شبکه سایر هالید های آن بیشتر است.
میانگین مقدار آنتالپی فروپاشی لیتیم فلوئورید و لیتیم برمید بیشتر از مقدار آنتالپی فروپاشی لیتیم کلرید است.
تفاوت انرژی شبکه بلور برای نمک های فلوئورید از همه بیشتر است.
در فلوئورید فلز ها از بالا به پایین با کاهش چگالی چگالی بار کاتیون میزان تفاوت آنتالپی فروپاشی این ترکیب ها کاهش می یابد.
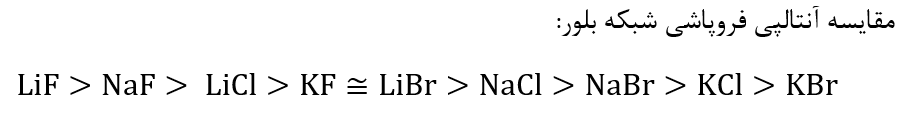
پس از دورۀ سنگی، در دورۀ برنز و سپس آهن، جوامع دچار دگرگونی و رشد چشمگیری شدند.
بسیاری باور دارند پایداری جامعه پیشرفته با فناوری کارآمد به گستردگی استفاده از عنصرهای فلزی وابسته است.
داشتن جلا، رسانایی الکتریکی، رسانایی گرمایی و شکل پذیری از جمله رفتارهای فیزیکی فلزها بوده در حالی که واکنش پذیری و تنوع اعداد اکسایش از جمله رفتارهای شیمیایی آنهاست.
رسانایی الکتریکی فلز ها یک فرایند فیزیکی است در حالی که رسانایی الکتریکی ترکیبات یونی که فقط در حالت مذاب یا محلول صورت می گیرد یک فرایند شیمیایی است. چون با عبور جریان برق از یک ترکیب یونی به حالت مذاب یا محلول در واقع برقکافت صورت گرفته که طی آن در کاتد و آند فرایند های شیمیایی صورت می گیرد.
مدل دریای الکترونی برای توجیه رفتار های فیزیکی فلز ها ارائه شده است.
بر اساس این مدل، ساختار فلزها آرایش منظمی از كاتیون ها در سه بعد است كه در فضای میان آنها سست ترین الكترون های موجود در اتم، دریایی را ساخته اند و در آن آزادانه جابه جا می شوند. الکترون های ظرفیت همان سست ترین الکترون ها هستند و راحت تر می توانند از جاذبه هسته خارج شوند.
اینکه الکترون ها می توانند آزادانه بین کاتیون ها جا به جا شوند سبب می شود که هر الکترون موجود در آن را نتوان متعلق به یک اتم معین دانست.
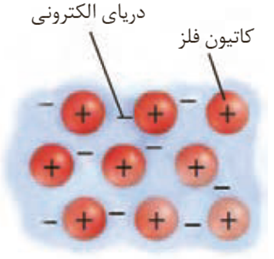
دریای الکترونی عاملی است که چیدمان کاتیون ها را در شبکه بلوری فلز حفظ می کند.
بر اثر ضربه شماری از کاتیون ها در شبکه بلوری فلز جا به جا می شوند اما چون دریای الکترون حرکت آزادانه دارد به طور همزمان لا به لای کاتیون ها جا به جا شده و نیزلا به لای سایر قسمت های شبکه بلوری حضور دارد بنابراین دریای الکترون مانند چسبی بین کاتیون ها جا به جا شده و مانع شکستن یا از هم شبکه بلوری می شود.
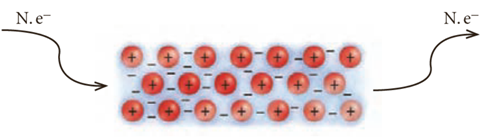
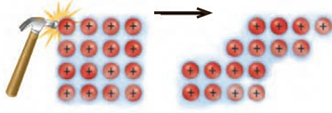
فلز ها در حالت جامد و مذاب رسانای خوب جریان برق اند. علت این است که بر اثر ایجاد اختلاف پتانسیل الکتریکی بین دو سر فلز شمار معینی الکترون از یک سو وارد دریای الکترونی شبکه بلوری فلز شده و این امر باعث می شود که تعادل بار الکتریکی شبکه بلوری فلز به هم بخورد و بنابراین همان تعداد الکترون در سمت مخالف فلز خارج شود تا تعادل الکتریکی شبکه فلز مجددا برقرار شود. این به معنی عبور جریان برق از فلز است.
به طور کلی احساس و درک رنگ به دلیل نورهایی است که از محیط پیرامون به چشم ما می رسد. این نورها همان پرتوهای الکترومغناطیسی بوده که طول موج آنها در گسترۀ 400 تا 700 نانومتر است.

اگر یک نمونه ماده همۀ طول موج های مرئی را بازتاب کند، به رنگ سفید و اگر همۀ آنها را جذب کند، به رنگ سیاه دیده می شود، همچنین چشم ما مواد رنگی را با طول موج های عبوری یا بازتاب شده از آنها می بیند.
اجسام سفید پرتو های مرئی را جذب نمی کنند اما ممکن است سایر پرتو های الکترومغناطیسی را که در بازه مرئی نیستند جذب کنند. و اجسام سیاه همه نور مرئی را جذب می کنند اما ممکن است بسیاری از پرتو های الکترومغناطیسی را جذب نکنند.
سازندۀ اصلی یك ماده رنگی كه به آن رنگ می بخشد، رنگ دانه نام دارد. در گذشته انسان، این مواد رنگی را از منابع طبیعی همچون گیاهان، جانوران و برخی كانی ها تهیه می كرد.

رنگ هایی كه برای پوشش سطح استفاده می شوند، نوعی کلویید هستند كه لایۀ نازکی روی سطح ایجاد می کنند تا افزون بر زیبایی، مانع خوردگی در برابر اکسیژن، رطوبت و مواد شیمیایی گردد.

با تغییر عدد اکسایش وانادیم جذب و بازتاب نور توسط رنگدانه های آن تغییر می کند.
نمک وانادیم با 5 بار مثبت فقط می تواند اکسنده باشد و دراین واکنش عدد اکسایش آن کاهش پیدا کرده است.
فلزها افزون بر رفتارهای مشابه، تفاوت های آشکاری در برخی رفتارها نشان می دهند، در واقع هر فلز افزون بر رفتارهای مشترك، رفتارهای ویژۀ خود را نیز دارد.
فلز های دسته d همانند فلز های دسته s و p دارای ویژگی هایی مانند جلا، رسانایی الکتریکی، رسانایی گرمایی و نیز شکل پذیری هستند، اما در ویژگی هایی مانند سختی، نقطه ذوب و تنوع عدد اکسایش با آنها تفاوت دارند.
چگالی فلزات واسطه بیشتر از اصلی هاست.
در یک دوره جدول نقطه ذوب و سختی فلز های گروه دوم از فلز های گروه اول بالاتر است. علت این است که در فلز های گروه اول به ازای هر اتم یک الکترون اما در گروه دوم به ازای هر اتم دو الکترون وارد دریای الکترون می شود و جاذبه آنها با دریای الکترون قوی تر است و نقطه ذوب و سختی فلز های گروه 13 بیشتر از گروه 2 است.
در فلز های گروه اول از بالا به پایین نقطه ذوب و سختی کاهش می یابد زیرا با افزایش شعاع کاتیون ها جاذبه آنها با دریای الکترون ضعیف تر می شود.
نقطه ذوب و جوش و سختی فلز های دسته d از دسته s و p بیشتر است.
بسیاری از فلز های دسته p می توانند همانند فلز های دسته d در ترکیب های خود بیش از یک نوع عدد اکسایش داشته باشند.
جیوه با اینکه یک فلز واسطه است اما در دمای اتاق مایع می باشد و نقطه ذوب و جوش آن از فلزات دسته s و p نیز پایین تر است.
نقطه ذوب و جوش فلز ها می تواند نسبت به ترکیبات یونی بالاتر یا پایین تر باشد.
ویژگی های تیتانیم:
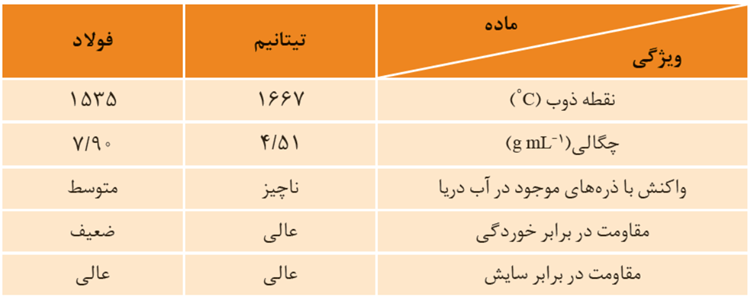
تیتانیم با گاز اکسیژن موجود در هواکره واکنش داده و اکسید می شود اما مثل Al در برابر خوردگی مقاوم است.
واکنش پذیری تیتانیم بیشتر از آهن است.
تیتانیم در ساخت موتور جت کاربرد دارد، علت این است که هنگامی که موتور جت کار می کند دمای بالایی دارد پس باید از فلزی استفاده بشود که نقطه ذوب بالایی دارد. همچنین به هنگام کار کردن جت اجزای مختلف آن به هم ساییده می شود و فلز مورد استفاده باید مقاومت سایشی بالایی داشته باشد.
به دلیل واکنش پذیری ناچیز تیتانیم با ذره های آب و مقاومت آن در برابر خوردگی امروزه در ساخت پروانه کشتی اقیانوس پیما به جای فولاد از تیتانیم استفاده می شود.
علاوه بر این ازآنجا که تیتانیم جلای فلزی زیبایی دارد برای ساخت بنا های هنرمندانه، زیبا و ماندگار همانند موزه گوگنهایم مناسب است. از آنجا که این موزه در شهر بندی با رطوبت و آلودگی بالا ساخته شده، بنابراین برای سازندگان مهم بود که پوشش بیرونی مقاومت خوبی در برابر خوردگی داشته باشد.
نیتینول آلیاژی از نیکل و تیتانیم بوده كه به آلیاژ هوشمند معروف است. این آلیاژ در ساخت فراورده های صنعتی و پزشکی به کار می رود.

سیلیسیم کربید یک سایندۀ ارزان است که در تهیۀ سنباده به کار می رود. از آنجا که پیوند Si-C نسبت به Si-Si طول کمتری دارد و اینکه Si-C یک پیوند قطبی است، آنتالپی و استحکام بیشتری دارد که باعث می شود سیلیسیم کربید نقطه ذوب و سختی بیشتری نسبت به سیلیسم داشته باشد.
و پیوند Si-C نسبت به C-C طول پیوند بیشتری دارد که باعث می شود نقطه ذوب و سختی الماس نسبت به سیلیسیم کربید بیشتر باشد.

به طور کلی یک جسم برای هدایت جریان برق باید ذره های باردار داشته باشد و این ذره ها باید بتوانند آزادانه حرکت کنند. ذره های تشکیل دهنده یک ترکیب یونی در حالت جامد در جاهای به نسبت ثابتی قرار دارند و در آنجا جز حرکت ارتعاشی حرکتی ندارند و جامد های یونی رسانای الکتریکی نیستند. اما وقتی ترکیب یونی ذوب می شود یا به میزان کافی در آب حل می شود، یون های تشکیل دهنده آن می توانند جریان برق را هدایت زیرا می توانند آزادانه حرکت کنند و با حرکت به سوی قطب های الکتریکی باعث رسانایی الکتریکی شوند.

اغلب نمک ها به نسبت سخت و شکننده اند تا زمانی که در یک ترکیب یونی لایه ها روی یکدیگر در ضعیت ثابتی قرار گرفته اند. چنانچه بر اثر ضربه چکش یکی از لایه ها اندکی جا به جا شود، آنگاه بار های ناهمنام کنار یکدیگر قرار می گیرند و اثر دافعه دافعه متقابل میان آنها به در هم ریختن شبکه بلور می انجامد.
مواد مولکولی شامل ترکیبات آلی نیز می شود، شمار ترکیبات شناخته شده از کربن از مجموع شمار ترکیبات شناخته شده از سایر عنصر ها بیشتر است و قرار گرفتن ترکیبات آلی در دسته مواد مولکولی سبب شده تنوع و شمار مواد مولکولی بیشتر از مواد کووالانسی است.
دمای ذوب جامد های کووالانسی یا جامد های یونی به قدری بالا است که در دمای اتاق نمی توان آنها را ذوب نمود، پس هنگامی که یک ترکیب به حالت مایع یا گاز است لابد دمای ذوب و جوش پایینی داشته و از ترکیبات مولکولی است.
سیلیسیم، فسفر و گوگرد از جمله عنصرهای اکسیژن دوست هستند.

در مولکول پروپان توزیع رنگ های آبی و قرمز تقریبا یکنواخت است و یک مولکول ناقطبی است، اما دی متیل اتر به دلیل داشتن اکسیژن و وجود پیوند قطبی C-O و وجود جفت الکترون ناپیوندی روی اکسیژن یک مولکول قطبی است و در میدان الکتریکی جهت گیری می کند.
نقطه جوش دی متیل اتر نسبت به پروپان بالاتر است زیرا جرم مولی دو ترکیب تقریبا یکسان است اما مولکول دی متیل اتر بر خلاف پروپان یک مولکول قطبی بوده و نیروی واندروالسی بین مولکول های آن قوی تر است و دی متیل اتر سریعتر مایع می شود.