دانش آموزان عزیز سلام💖
در این مطلب قصد داریم نکات فصل یک شیمی دهم را به همراه سوالات نهایی و کنکور در اختیار شما قرار دهیم تا آمادگی لازم را برای آزمون پیش رو کسب کنید. فایل پی دی اف شامل سوالات نهایی و کنکور را در انتهای مطلب مشاهده می کنید.
| ساختار لوویس-فصل دو شیمی دهم-خلاصه نکات و تست-رویا خواجوی | رویا خواجوی رتبه 8 منطقه 3 کنکور تجربی 1403 دانشجوی دندان پزشکی دانشگاه شهید بهشتی |

«در ابتدا برای درک اهمیت این مبحث سوالاتی که در امتحان نهایی دهم آورده شده را باهم بررسی میکنیم. بعد از خواندن درسنامه سعی کنید به سوالات پاسخ بدهید و بعد جوابتان را با پاسخنامه فایل ضمیمه مقایسه کنید.»
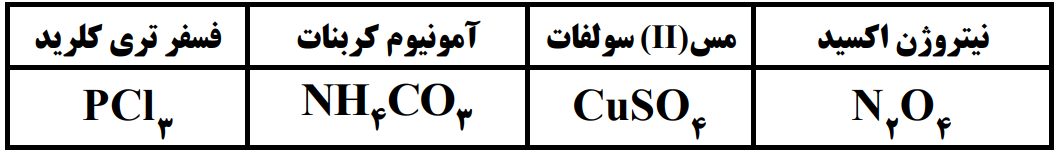
- ⭕در جدول زیر نام یا فرمول شیمیایی برخی از ترکیب ها اشتباه نوشته شده است. موارد نادرست را پیدا کنید و نام یا فرمول شیمیایی درست آنها را در پاسخنامه بنویسید.
⭕به پرسش ها پاسخ دهید.
الف) نام ترکیب مولکولی N2O را بنویسید.
ب) فرمول شیمیایی ترکیب یونی پتاسیم پرمنگنات به صورت KMnO4 است. فرمول شیمیایی کلسیم پرمنگنات را بنویسید.
ج) دانش آموزی ترکیب یونی ZnSO4 را به صورت (روی ll سولفید) نامگذاری کرده است. در این نامگذاری دو اشتباه وجود دارد. نام درست آن را در پاسخنامه بنویسید.
د) چرا ترکیب یونی منیزیم کلرید از نظر بار الکتریکی خنثی است؟
- ⭕با توجه به ساختارهای لوویس داده شده، به پرسش ها پاسخ دهید.
آ) کدام ساختار نادرست است؟ ساختار صحیح مورد نادرست را در پاسخنامه بنویسید.
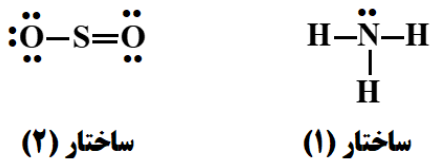
ب) شمار جفت الکترون های پیوندی و ناپیوندی را برای مولکول تعیین کنید.
- ⭕به پرسش های زیر پاسخ دهید.
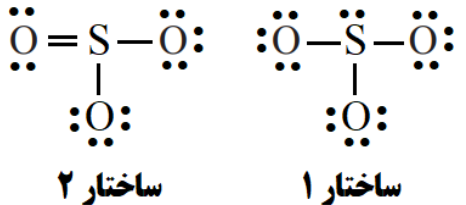
آ) کدام ساختار لوویس برای مولکول SO 3 ، نادرست است؟ چرا؟
ب) با استفاده از جدول دوره ای عنصرها، جرم مولی SO3 را بر حسب گرم بر مول به دست آورید.
تركیب اكسیژن با فلزها و نافلزها
اكسیژن در سنگ کره به شکل اکسیدهای گوناگون نیز یافت می شود. مانند بوکسیت (Al2O3 به همراه ناخالصی) و سیلیس (SiO2).
افزون بر فلزهایی مانند طلا و پلاتین که به حالت آزاد در طبیعت یافت می شوند، فلزهایی نیز وجود دارند که با بیش از یک نوع اکسید در طبیعت شناخته شده اند. مانند آهن با دو اکسید Fe2O3 و FeO.
اغلب فلزها در شرایط مناسب با گاز اکسیژن می سوزند.

نامگذاری ترکیب فلزات چند ظرفیتی:
برخی فلز ها بیش از یک نوع کاتیون پایدار دارند، در حد کتاب درسی سه فلز آهن، کروم و مس می توانند یون های با بار مثبت متفاوت ایجاد کنند.
برای نامگذاری ترکیبات یونی فلزاتی که یون های متنوعی تشکیل می دهند، باید بار کاتیون را با عدد های رومی مشخص کنیم.
🔺برای مثال: CrF3← کروم (lll) فلوئورید
مهم ترین فلزات با یک نوع کاتیون:
فلزات قلیایی ، فلزات قلیایی خاکی ، آلومینیوم ، روی ، کادمیم ، نقره ، اسکاندیم
واکنش عنصرها با اکسیژن، تنها به فلزها محدود نمی شود بلكه نافلزها نیز با آن واكنش می دهند و به اكسید نافلزها تبدیل می شوند.
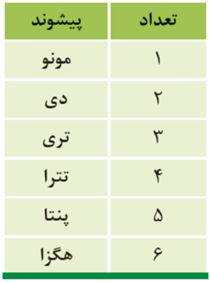
نامگذاری ترکیبات مولکولی:
نخست، شمار و نام عنصری که سمت چپ فرمول شیمیایی نوشته شده است و سپس شمار و نام عنصر دوم با پسوند (ید) بیان می شود.
اگر در فرمول مولکولی یک ترکیب، تنها یک اتم از عنصر سمت چپ وجود داشته باشد، از به کار بردن پیشوند مونو پیش از نام این عنصر چشم پوشی می شود.
🔺مثال: N2O3← دی نیتروژن تری اکسید NO←نیتروژن مونوکسید
برای ترکیب های هیدژون گروه 17 برای عنصر دوم هم از پیشوند مونو استفاده نمی کنیم، زیرا هیدروژن با عنصر های گروه 17 فقط یک نوع ترکیب دوتایی با فرمول کلی HX تشکیل می دهد.
در فرمول مولکولی، اتمی كه سمت چپ نوشته می شود (به جز اتم هیدروژن) ، اتم مركزی است و اتم های دیگر با یك، دو یا سه پیوند اشتراکی به آن متصل می شوند.
مجموع الكترون های پیوندی و ناپیوندی در مولكول، برابر با مجموع الكترون های لایۀ ظرفیت اتم های سازندۀ آن باشد.
همۀ اتم ها به آرایش هشت تایی رسیده باشند (اتم هیدروژن همواره یك پیوند تشكیل می دهد، از این رو تنها با دو الكترون پایدار می شود).
ساختار لوویس
برای رسم ساختار لوویس مراحل زیر ر انجام می دهیم:
- 1️⃣محاسبه شمار کل الکترون های لایه ظرفیت اتم ها
- 2️⃣تعیین اتم مرکزی و چیدمان اتم ها
- 3️⃣اغلب نخستین اتم از سمت چپ اتم (به جز هیدروژن) اتم مرکزی است. این اتم را وسط قرار داده و بقیه را اطراف آن می چینیم. (دو استثنای مهم: Cl2O، SCO که به ترتیب O و C اتم مرکزی هستند).
- در مولکول های دو اتمی اتم مرکزی معنی ندارد.
- 4️⃣وصل کردن اتم های اطراف به اتم مرکزی با پیوند و هشتایی کردن اتم های اطراف اتم مرکزی.
- محاسبه باقی مانده الکترون های ظرفیتی و قرار دادن آنها روی اتم مرکزی.
- هشتایی کردن اتم مرکزی.
- اگر اتم مرکزی هنوز هشتایی نشده بود، اتم های مجاور را به صورت یک پیوند جدید بین اتم های مجاور و اتم مرکزی در می آوریم تا با تشکیل پیوند های اضافی اتم مرکزی را هشتایی کنیم.
- هرگاه اتم عنصرهای گروه17 ، اتم كناری باشند، تنها یك پیوند اشتراکی تشكیل می دهند.
در رسم ساختار لوویس، هنگامی که اتم های یکسانی به اتم مرکزی متصل اند، نمایش پیوند دوگانه بر پیوند سه گانه مقدم است.
در مواردی که اتم های یکسانی به اتم مرکزی متصل نیستند ممکن است پیوند سه گانه به دوگانه تقدم داشته باشد مثل N2O که یک پیوند یگانه بین نیتروژن و اکسیژن و یک پیوند سه گانه بین دو اتم نیتروژن وجود دارد.
مجموع الكترون های پیوندی و ناپیوندی درساختار لوویس مولكول، باید برابر با مجموع الكترون های لایۀ ظرفیت اتم های سازندۀ آن باشد.
شمار کل تعداد پیوند های اشتراکی:
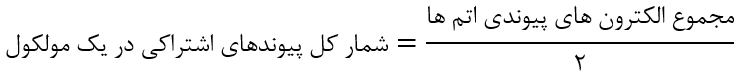
ساختار لوویس یون های چند اتمی:
مراحل رسم ساختار لوویس یون های چند اتمی دقیقا مشابه رسم ساختار لوویس مولکول هاست با این تفاوت که:
- شمار کل الکترون های به کار رفته در ساختار لوویس یون ها= مجموع شمار الکترون های ظرفیتی اتم های سازنده-بار یون با علامت
- بار یون متعلق به همه اتم های سازنده است، بنابراین ساختار به دست آمده در آخرین مرحله را درون کروشه قرار می دهیم وبار یون را بالا سمت راست کروشه می نویسیم.

بار یون= مجموع شمار الکترون های لایه ظرفیت- مجموع شمار الکترون های به کار رفته در ساختار لوویس
اکسید ها فراورده های سوختن:
از ویژگی واکنش پذیری زیاد اکسیژن برای تهیه بسیاری از مواد بهره می گیرند، برای نمونه در صنعت برای تهیه سولفوریک اسید، نخست گوگرد را در واکنش با اکسیژن به SO2 تبدیل می کنند. واکنشی که به سوختن گوگرد معروف است.
سوختن، واكنشی شیمیایی است که در آن، یک ماده با اکسیژن به سرعت واکنش می دهد و بخشی از انرژی شیمیایی آن به صورت گرما و نور آزاد می شود.
اکسایش به معنای واکنش آرام مواد با اکسیژن است.
اغلب فلزها در شرایط مناسب با گاز اکسیژن می سوزند. رنگ شعله سوختن آهن نارنجی، سدیم زرد، منیزیم سفید و گوگرد آبی است.

سوختن زغال سنگ:
زغال سنگ + اکسیژن ← بخار آب + گوگرد دی اکسید + کربن دی اکسید + نور و گرما
عنصر اصلی سازنده زغال سنگ کربن است اما در ساختار آن عناصر دیگری مانند گوگرد و نیتروژن و هیدروژن نیز وجود دارد، به همین دلیل در فراورده های سوختن آن علاوه بر کربن دی اکسید، موارد دیگری مانند گوگرد دی اکسید و بخار آب را نیز می بینیم.
نوع فراورده ها در واكنش سوختن سوخت های فسیلی، به مقدار اكسیژن در دسترس بستگی دارد؛ به طوری که اگر اكسیژن كافی باشد، سوختن كامل انجام می شود و گاز كربن دی اكسید و بخار آب تولید می گردد. اما اگر مقدار اكسیژن كم باشد، گاز كربن مونوكسید به همراه دیگر فراورده ها تولید خواهد شد؛ در این حالت گفته می شود سوختن ناقص است.
رنگ زرد شعله، نشان دهندۀ سوختن ناقص است و رنگ آبی شعله، نشان می دهد كه وسیلۀ گازسوز به درستی كار می کند و اكسیژن كافی در محیط واكنش وجود دارد.
کربن مونوکسید از کربن دی اکسید ناپایدار تر است و در حضور اکسیژن و در شرایط مناسب دوباره می سوزد و به کربن دی اکسید تبدیل می شود.
کربن مونوکسید
كربن مونوكسید، گازی بی رنگ، بی بو و بسیار سمّی است. چگالی این گاز كمتر از هوا و قابلیت انتشار آن در محیط بسیار زیاد است؛ به طوری که به سرعت در همۀ فضای اتاق پخش می شود.
از آنجا که میل تركیبی هموگلوبین خون با این گاز بسیار زیاد و بیش از 2۰۰ برابر اكسیژن است، مولكول های آن پس از اتصال به هموگلوبین از رسیدن اكسیژن به بافت های بدن جلوگیری می کنند. این ویژگی باعث مسمومیت می شود و سامانۀ عصبی را فلج می کند به طوری که قدرت هرگونه اقدامی را از فرد مسموم می گیرد و بدین ترتیب باعث مرگ می شود.
بیشتر مرگ و میرهای ناشی از گاز گرفتگی به دلیل رعایت نکردن اصول ایمنی هنگام استفاده از وسایل گرمایشی است. امروزه در برخی خانه ها از دستگاهی برای اعلام نشت گاز کربن مونوکسید استفاده می کنند.

رفتار اکسید های فلزی و نافلزی
به طور کلی، اكسیدهای فلزی را اكسیدهای بازی و اكسیدهای نافلزی را اكسیدهای اسیدی می نامند؛ زیرا از واكنش اغلب آنها با آب به ترتیب باز و اسید تولید می شود.
برخی كشاورزان كلسیم اكسید (آهک) را به عنوان اكسیدفلزی برای افزایش بهره وری در كشاورزی به خاك می افزایند؛ زیرا افزودن این نوع مواد به خاك سبب می شود تا مقدار و نوع مواد معدنی در دسترس گیاه تغییر كند. همچنین از كلسیم اكسید برای كنترل میزان اسیدی بودن آب دریاچه ها استفاده می شود. از آنجا که آهک خاصیت بازی دارداگر خاک زمین های کشاورزی یا آب دریاچه ها اسیدی تر از حد انتظار باشد، می توان به کمک آهک پی اچ را بالا برد و به حد مطلوب رساند.
مرجان ها، گروهی از كیسه تنان با اسكلت آهكی هستند. پژوهش ها نشان می دهند كه این جانداران با افزایش مقدار كربن دی اكسید محلول در آب از بین می روند زیرا خاصیت اسیدی آب افزایش می یابد. (چند مورد استثنا داریم که محلول آبی آنها خنثی است: CO، NO، N2O)
کاغذ پی اچ در محلول های اسیدی به رنگ سرخ و در محلول های بازی به رنگ آبی در می آید.


