توجه:
شما با مطالعه این درسنامه می توانید به سوالات 881-900 از کتاب نوروز و سوالات 112،113،114،283،284،620،780،928،1087،12171261از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
دانش آموزان عزیز سلام
در این مطلب قصد داریم نکات مربوط به فصل 3 با عنوان شیمی جلوه ای هنر، زیبایی و ماندگاری از شیمی دوازدهم را به همراه سوالات نهایی و کنکور در اختیار شما قرار دهیم.
 | درسنامه شامل : خلاصه مطالب و نکات 5 تست کنکور سال های اخیر سوالات نهایی مربوطه |
سوالات نهایی:
با توجه به جدول به پرسش ها پاسخ دهید.

الف)با در نظر گرفتن اینکه Si در طبیعت به حالت خالص یافت نشده و به طور عمده به شکل سیلیس یافت می شود، X کدام عدد (368 یا 168) می تواند باشد؟
ب)سختی کدام یک از جامد های کووالانسی SiیاSiC بیشتر است؟ چرا؟

یکی از سازنده های اصلی بسیاری از سنگ ها، صخره ها و نیز شن و ماسه است. (SiO2/Si)
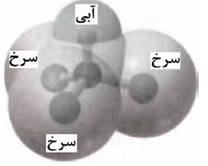
نقشه پتانسیل رو به رو مربوط به مولکول یک مایع است توضیح دهید آیا نزدیک کردن میله شیشه ای باردار به باریکه این مایع می توان آن را از راستای حرکت آن منحرف نمود؟

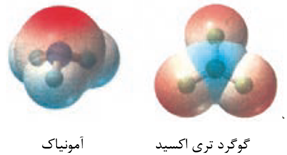
با توجه به نقشه پتانسیل مولکول های آمونیاک و گوگرد تری اکسید به پرسش ها پاسخ دهید.
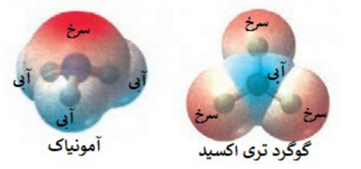
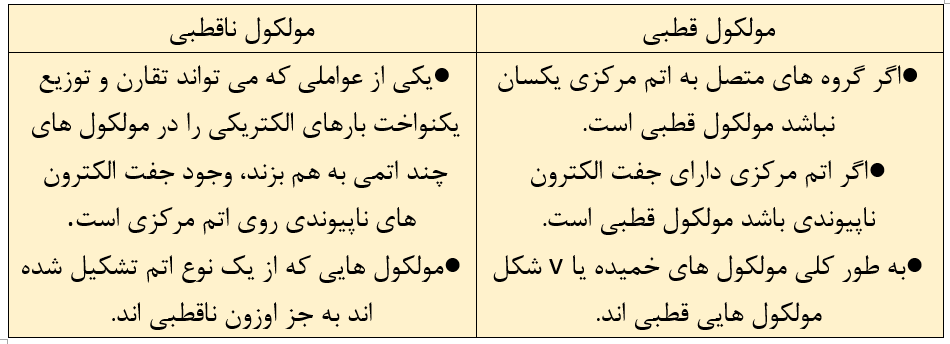
الف)کدام مولکول در میدان الکتریکی جهت گیری می کند؟ چرا؟
در مولکول SO2 تراکم بار الکتریکی روی کدام اتم بیشتر است؟ (گوگرد یا اکسیژن)
با انحلال کدام ماده در آب غلظت یون هیدرونیوم افزایش می یابد؟

آ)شکل مقابل، نقشه پتانسیل الکتروستاتیکی کدام مولکول OF2 یا H2O را نشان می دهد؟دلیل انتخاب خود را بنویسید.
ب)آیا این مولکول در میدان الکتریکی جهت گیری می کند؟ چرا؟


درسنامه:
شمار بسیاری ماده با رفتارهای گوناگون، تنها از شمار معینی اتم با آرایش و چیدمانی نظام مند پدید آمده اند.
در تغییر مواد، افزون بر محیط و شیوۀ زندگی، آیین ها، آداب و رسوم و حتی ادبیات و افسانه ها نیز نقش داشته اند. با این توصیف، هر یک از آثار به جای مانده ازگذشتگان در جهان را می توان نمادی از هنر زمان خویش دانست که افزون بر زیبایی، بازتابی از ماندگاری آن اثر نیز به شمار می رود.

مواد اولیه برای ساخت چنین آثاری افزون بر فراوانی و در دسترس بودن، باید واکنش پذیری کم، استحکام زیاد و پایداری مناسبی داشته باشند. توجه کنید که عمر طولانی این آثار، تأییدی بر این ویژگی ها است.
شیمی دان ها در گام نخست نوع، مقدار، ساختار و رفتار مواد سازندۀ آثار به جا مانده را بررسی كردند، سپس با بهره گیری از دانش شیمی توانستند به مواد جدیدتری دست یابند.
درصد جرمی مواد سازندۀ نوعی خاک رس
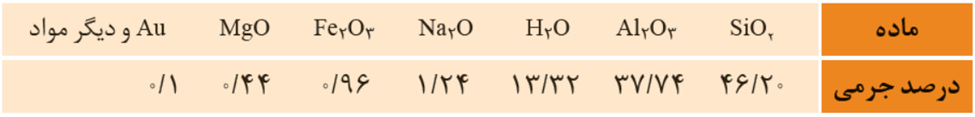
سه ترکیب اصلی خاک رس: SiO2>Al2O3>H2O
حدود 80 درصد جرمی خاک رس را SiO2 و Al2O3 تشکیل می دهد.
سرخ فام بودن خاک رس را به وجود Fe2O3 نسبت می دهند.
هنگام حرارت دادن خاک رس آب تبخیر شده و جرم آن در خاک به شدت کاهش می یابد و درصد جرمی سایر اکسید ها افزایش می یابد.

ترکیب یونی: Na2O Al2O3 MgO Fe2O3

ترکیب مولکولی: H2O

جامد فلزی: Au
قدرت پیوند کووالانسی بیشتر از پیوند یونی و پیوند یونی بیشتر از نیروی های بین مولکولی است.
پیوند هیدروژنی فقط برای مواد مولکولی مطرح است.
یافته های تجربی نشان می دهد که سیلیسیم دی اکسید افزون بر خاک رس یکی از سازنده های اصلی بسیاری از سنگ ها، صخره ها و نیز شن و ماسه است. وجود این ماده باعث استحکام و ماندگاری سازه های سنگی و نقشکنده های روی آنها شده است.
سیلیسیم پس از اکسیژن فراوان ترین عنصر در پوستۀ جامد زمین (نه کل زمین) است به طوری که ترکیب های گوناگون این دو عنصر بیش از 90 % پوستۀ جامد زمین را تشکیل می دهند، از این رو سیلیس فراوان ترین اکسید در این لایه از سیارۀ ما به شمار می رود.کوارتز از جمله نمونه های خالص و ماسه از جمله نمونه های ناخالص سیلیس است.
فراوان ترین عناصر در کل زمین: Fe>O>Si
فراوان ترین عناصر در پوسته جامد زمین: O>Si
ساختار سیلیسیم با کربن و ساختار سیلیس با کربن دی اکسید متفاوت است.
سیلیس خالص به دلیل داشتن خواص نوری ویژه در ساخت منشورها و عدسی ها به کار می رود.

در ساختار سیلیس هر کدام از 12 ضلعی ها توسط 6 ضلعی هایی احاطه شده که هر یک شامل 3 اتم اکسیژن و 3 اتم سیلیسیم بوده است و این 6 ضلعی ها مشابه شبکه بلور یخ نیست چون در 6 ضلعی های شبکه بلور یخ در هر ضلع 3 اتم وجود دارد و در 6 ضلعی های سیلیس هر ضلع شامل 2 اتم.
در ساختار سیلیس فقط پیوند بین سیلیسیم و اکسیژن وجود دارد.
به دلیل قرارگیری یکی در میان اتم های سیلیسیم و اکسیژن و زوج بودن تعداد اتم های سازنده حلقه ها تعداد اتم های اکسِیژن و سیلیسیم در حلقه با هم برابر می باشد.
هر اتم اکسیژن با دو اتم سیلیسیم پیوند اشتراکی دارد و هر اتم سیلیسیم به چهار اتم اکسیژن متصل است.

مقایسه کربن دی اکسید و سیلیس:
كه مواد مولكولی در ساختار خود مولكول های مجزا دارند و کربن دی اکسید از مواد مولکولی محسوب می شود، در حالی که ماده كووالانسی مجموعه ای از اتم های بسیاری است كه با هم پیوندهای اشتراكی دارند ساختاری که دلیلی بر سختی بالا و دیرگداز بودن چنین موادی است. از آنجا که این مواد در دما و فشار اتاق به حالت جامد هستند، آنها را با نام جامد کووالانسی نیز می خوانند. که عنصرهای اصلی سازندۀ جامدهای کووالانسی در طبیعت، کربن و سیلیسیم هستند و سیلیس، شامل شمار بسیار زیادی از اتم های سیلیسیم و اکسیژن با پیوندهای اشتراکی Si-O-Si بوده و دارای ساختاری به هم پیوسته و غول آساست و جامد کووالانسی محسوب می شود.
مقایسه کربن دی اکسید و سیلیسیم دی اکسید:
سیلیس سخت تر از کربن دی اکسید می باشد چون هنگام خراش دادن آن باید بر پیوند های کووالانسی غلبه شود که پیوند هایی قوی و محکم هستند بنابراین سیلیس به راحتی خراشیده نمی شود. و نقطه ذوب بالاتری نیز دارد چون به هنگام ذوب کردن آن باید بر پیوند های کووالانسی سیلیسیم اکسیژن غلبه کنیم که نیاز به دمای بالایی دارد.
پختن نان سنگک بر روی دانه های درشت سنگ را می توان نشانه ای از مقاومت گرمایی سیلیس دانست.
مقایسه سیلیس و سیلیسیم:
آنتالپی پیوند پیوند های سیلیس بیشتر از سیلیسیم می باشد. نسبت شمار جفت الکترون های پیوندی به شمار اتم های سیلیسیم بیشتر است. پایداری سیلیس بیشتر از سیلیسیم می باشد و سیلیس شفاف تر است.
دو عنصر کربن و سیلیسیم از آنها تا کنون یون تک اتمی در هیچ ترکیبی ساخته نشده است زیرا با تشکیل پیوند های اشتراکی به آرایش الکترونی هشت تایی می رسند.
کربن در طبیعت به صورت خالص یافت می شود اما سیلیسیم به حالت خالص وجود ندارد.
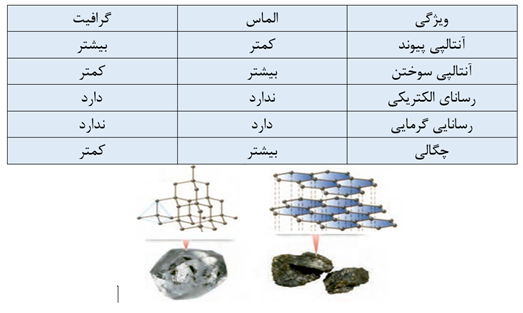
مقایسه کربن و الماس:
به علت همپوشانی الکترون های منفرد در گرافیت پیوند C-C کمی خصلت دوگانه پیدا کرده و باعث کوتاه تر شدن پیوند در گرافیت نسبت به الماس و آنتالپی پیوند آن نیز بیشتر است.و پایداری گرافیت نیز از الماس بیشتر است.
در الماس هر اتم کربن با 4 پیوند کووالانسی یگانه به 3 اتم کربن متصل است. و الماس هر اتم کربن به 4 اتم کربن دیگر با 4 پیوند کووالانسی متصل است.
هر بلور الماس یک مولکول غول آسا محسوب می شود در حالی که هر بلور گرافیت دارای شمار زیادی مولکول غول آسا که هر لایه یک مولکول محسوب می شود.
در هر لایه گرافیت هر اتم کربن به سه اتم کربن دیگر متصل است و پیرامون هر اتم کربن یک آرایش سه ضلعی مسطح با زاویه 120 درجه به وجود می آید. از اتصال 6 اتم کربن در گرافیت شش گوشه هایی ایجاد می شود.
به ازای هر n اتم کربن در الماس 2n پیوند اشتراکی بین اتم های کربن وجود دارد.
چینش اتم ها در الماس به صورت 3 بعدی و در کربن به صورت 2 بعدی مشاهده می شود.
در گرافیت اتم ها به صورت لایه لایه آرایش یافته اند و بین لایه ها نیروی بین مولکولی ضعیفی وجود دارد به طوری که هر لایه به راحتی می تواند روی لایه دیگر بلغزد. توانایی لغزش لایه ها روی هم باعث نرمی آن شده است. برای همین به عنوان مغر مداد از آن استفاده می شود.
در مقابل الماس به دلیل شبکه به هم پیوسته و غول آسایی از پیوند های کووالانسی بسیار سخت است و این سختی زیاد سبب شده است که از آن در ساخت مته ها و ابزار برش شیشه استفاده شود.
چگالی الماس و گرافیت هر دو از آب بیشتر می باشد.
اگر سیلیسیم خالص ساختاری همانند الماس داشته باشد، با توجه به اینکه شعاع اتمی سیلیسیم از شعاع اتمی کربن بزرگتر است میانگین آنتالپی پیوند سیلیسیم نسبت به کربن کمتر بوده و نقطه ذوب آن کمتر است.
اگر آنتالپی پیوند Si-O بیشتر از پیوند Si-Si و ساختار Si با SiO2 مشابه باشد از آنجایی که پیوند Si-O نسبت به Si-Si محکم تر و پایدار تر است باعث می شود سیلیسیم دی اکسید نسبت به سیلیسیم پایداری بیشتری داشته باشد. و سیلیسیم ترجیح می دهد به جای اینکه به صورت Si(s) باشد با اکسیژن واکنش داده و به شکل SiO2 در آید.
گرافن، تک لایه ای از گرافیت است که در آن، اتم های کربن با پیوندهای اشتراکی حلقه های شش گوشه تشکیل داده اند. چنین ساختاری با الگویی مانند کندوی زنبور عسل، استحکام ویژه ای دارد به طوری که مقاومت کششی آن حدود 100 برابر فولاد است. همچنین یک گونه شیمیایی دو بعدی شفاف و انعطاف پذیر است.
آزمایش اثبات می کند که گرافیت رسانایی الکتریکی بالایی دارد و هر چه فاصله نوک دو سیم روی چهارگوشه گرافیتی بیشتر باشد مقاومت الکتریکی گرافیتی بیشتر شده و شدت روشنایی لامپ کمتر می شود.
مولکول های آب در ساختار یخ در یک آرایش منظم و سه بُعدی با تشکیل حلقه های شش گوشه(نه 6 وجهی)، شبکه ای همانند کندوی زنبور عسل با استحكام ویژه پدید می آورند. در این ساختار هر اتم اکسیژن به دو اتم هیدروژن با پیوند اشتراکی و به دو اتم هیدروژن از مولکول های دیگر با پیوندهای هیدروژنی متصل است. این در حالی است که در سیلیس همه اتم ها با پیوندهای اشتراكی به یكدیگر متصل شده اند. در حلقه های 6 ضلعی یخ هر ضلع شامل یک پیوند کووالانسی و یک پیوند هیدروژنی است.
اغلب ترکیب های آلی جزو مواد مولکولی هستند.
واژه های ماده مولکولی، فرمول مولکولی و نیرو های بین مولکولی فقط برای ترکیبات مولکولی قابل استفاده می باشد(مثلا Cl2 HF C6H14) اما واژه نیروی بین مولکولی به طور استثنا در مورد گرافیت نیز به کار می رود.
رفتار فیزیکی مواد مولکولی به نوع و قدرت نیروهای بین مولکولی آنها بستگی دارد. برای نمونه آنتالپی تبخیر و نقطه جوش یک تركیب مولكولی به حالت مایع به نیروهای بین مولکولی آن وابسته است، در حالی که رفتار شیمیایی آن به طور عمده به پیوندهای اشتراکی (جفت الکترون های پیوندی) و جفت الکترون های ناپیوندی موجود در مولکول وابسته است.
ترکیب هایی که در دمای اتاق مایع یا گاز هستند جز مواد مولکولی اند چون دمای ذوب جامد های کووالانسی یا یونی به قدری بالا است که در دمای اتاق نمی توان آنها را ذوب کرد. (جیوه ترکیب نیست و فلزی است که در دمای اتاق مایع است)
در مواد کووالانسی هم رفتار فیزیکی هم شیمیایی به پیوند های اشتراکی بین اتم ها وابسته است. جامد نبودن در دمای اتاق جز ویژگی های ترکیبات مولکولی نیست چون بسیاری از ترکیبات مولکولی موادی جامدند.
پیوند C-H با اینکه بین 2 اتم متفاوت ایجاد شده اما یک پیوند کووالانسی ناقطبی است چون تفاوت خاصیت نافلزی بین کربن و هیدروژن ناچیز است.
برخی ترکیبات مولکولی مثل HClو HFدر آب رسانا اند.
مولکول هایی که از دو اتم یکسان تشکیل شده اند مولکول دو اتمی جور هسته نامیده می شوند.
و چنین مولکول هایی در میدان الکتریکی جهت گیری نمی کنند. و مولکول های دو اتمی مانند HCl مولکول دو اتمی ناجور هسته بوده و قطبی هستند.

توزیع یکنواخت و متقارن الکترون ها در مولکول های دو اتمی جور هسته، نشانۀ ناقطبی بودن آن است در حالی که در مولکول های دو اتمی ناجور هسته، توزیع الکترون ها یکنواخت نبوده و تراکم بار الکتریکی روی اتم های سازندۀ آن یکسان نیست.
به اتمی که تراکم بار الکتریکی روی آن بیشتر است، بار جزئی منفی (δ -) و به دیگری بار جزئی مثبت (δ+) نسبت می دهند.
در مولکول خطی سه اتمی، هسته هر سه اتم سازندۀ آن بر روی یک خط راست قرار دارند.
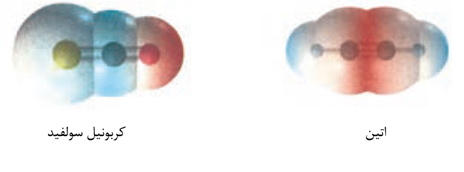
در اتین تراکم بار منفی در فضای هسته بین دو اتم کربن بیشتر از سایر نقاط است.
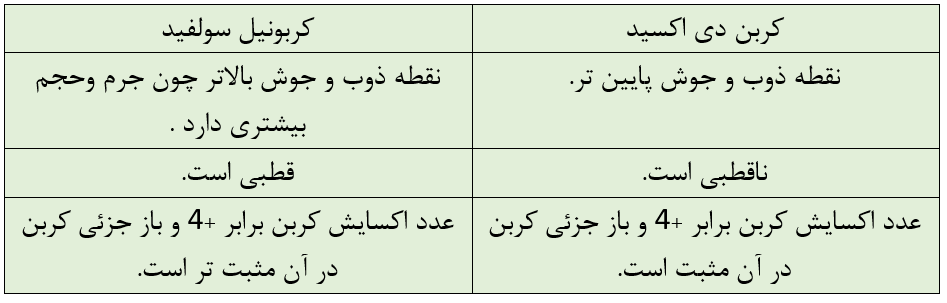
در کربونیل سولفید در پیوند C=S توزیع الکترون بین دو اتم گوگرد و کربن تقریبا یکسان است و پیوند کووالانسی پیوند ناقطبی است. C=O یک پیوند قطبی است.
خورشید بزرگ ترین منبع انرژی برای زمین است.
دانشمندان برای استفاده بهینه از انرژی خدادادی و رایگان خورشید به دنبال فناوری هایی هستند كه بتوانند بخشی از آن را ذخیره نموده و به شكل انرژی الكتریكی وارد چرخه مصرف نمایند.
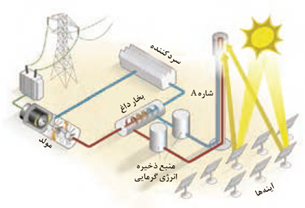
آینه ها پرتو های خورشید را روی برج گیرنده متمرکز می کنند.
سدیم کلرید مذاب شاره بسیار داغی است که باعث تولید بخار داغ می شود.
بخار آب شاره ای است که توربین را به حرکت در می آورد.
شاره ای که باید پرتو های خورشیدی را دریافت و انرژی آن را به صورت گرما ذخیره کند باید یک ماده یونی باشد نه مولکولی. علت این است که ترکیب های یونی نسبت به مواد مولکولی در گستره دمایی بیشتری به حالت مایع باقی می ماند و مقدار بیشتری از انرژی پرتو های خورشیدی را می تواند در خود ذخیره کند.
هر چه تفاوت بین نقطه ذوب و جوش یک ماده خالص بیشتر باشد، آن ماده در گستره دمایی بیشتری به حالت مایع بوده و نیروی با متمرکز شدن پرتوهای خورشیدی بر روی گیرندۀ برج، دمای سدیم کلرید مذاب افزایش می یابد و این شاره بسیار داغ به منبع ذخیره انرژی گرمایی سرازیر می شود تا حتی در روزهای ابری و شب هنگام، انرژی لازم برای تبدیل آب به بخار داغ را فراهم كند. بخار داغ، توربین را برای تولید انرژی الکتریکی به حرکت در می آورد. جاذبه میان ذره های سازنده آن مایع قوی تر است.


