توجه:
شما با مطالعه این درسنامه می توانید به سوالات 801-820 از کتاب نوروز و سوالات 87،102،109،110،279،281،439،448،449،455،618،622،755،765،777،778،927،931،933،1078،1084،1085،1086،1234،1238،1240،280،619از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
دانش آموزان عزیز سلام
در این مطلب خلاصه نکات بخش انتهایی فصل دو شیمی دوازدهم را به همراه تست کنکور و سوالات نهایی در اختیار شما قرار داده ایم .
 | درسنامه شامل : خلاصه مطالب و نکات 5 تست کنکور سال های اخیر سوالات نهایی مربوطه |
سوالات نهایی مربوط به مبحث :
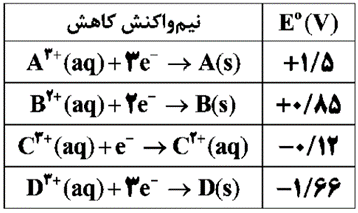
در جدول زیر پتانسیل کاهشی استاندارد برخی نیم سلول ها داده شده است .
الف) در سلول گالوانی تشکیل شده از دو فلز A و D جرم کدام تیغه کاهش می یابد؟
گدام گونه(ها) می تواند را اکسید کند؟
کدام گونه قوی ترین کاهنده است؟
برای آبکاری حلقه ای از جنس فلز D با فلز A محلول الکترولیت باید حاوی کدام کاتیون باشد؟

در نوعی سلول سوختی از متانول برای تولید انرژی الکتریکی استفاده می شود . اگر نیم واکنش های انجام شده در این سلول سوختی به صورت زیر باشد .
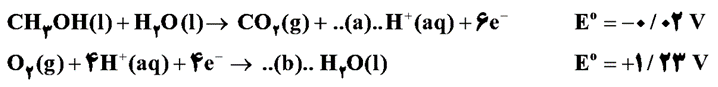
الف) ضرایب a و b را بنویسید.
ب)عدد اکسایش کربن در CH3OH را تعیین کنید.
ج)در واکنش کلی سلول چند مول الکترون مبادله می شود؟
د)Emfسلول را محاسبه کنید.
در آبکاری یک بند ساعت با طلا، فلز طلا به این قطب متصل می شود.(مثبت/منفی)
هر سلول گالوانی ولتاژ معینی دارد، اما با تغییر هر یک از اجزای سلول، ولتاژ تغییر می کند. درست
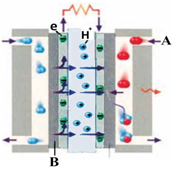
شکل زیر یک سلول سوختی (هیدروژن/اکسیژن) را نشان می دهد. با توجه به آن پرسش ها پاسخ دهید.
آ)این فرایند در چه سلولی (گالوانی یا الکترولیتی) انجام میشود؟ چرا؟
ب)به جای A و B واژه توصیفی یا نماد شیمیایی مناسب قرار دهید.
پ)فراورده نهایی در این سلول سوختی چیست؟
ت)یک چالش در رابطه با این سلول سوختی بنویسید.

درسنامه و خلاصه نکات :
یافتن جایگزینی مناسب برای سوخت های فسیلی ضروری است.
استخراج و مصرف بی رویۀ این سوخت ها سبب شده تا از ذخایر آنها به سرعت کاسته شود.
گسترش روزافزون آلودگی ناشی از مصرف سوخت های فسیلی، جهان را با چالشی نگران کننده روبه رو كرده است .
سلول سوختی نوعی سلول گالوانی است .
این سلول ها افزون بر كارایی بیشتر می توانند ردپای كربن دی اكسید را كاهش دهند به طوری كه دوستدار محیط زیست بوده و منبع انرژی سبز به شمار می روند .
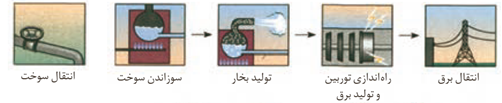 تولید انرژی الکتریکی با سوزاندن سوخت فسیلی
تولید انرژی الکتریکی با سوزاندن سوخت فسیلی
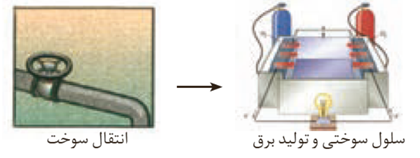
تولید انرژی الکتریکی با سلول سوختی
در روش دوم اتلاف انرژی به شکل گرما کمتر است (البته هم درس اول و هم در روش دوم اتلاف انرژی گرمایی وجود دارد) زیرا روش دو فاقد واکنش سوختن و انرژی شیمیایی به انرژی گرمایی تبدیل نمی شود بلکه به طور مستقیم به انرژی الکتریکی تبدیل می شود . و کارایی روش دوم بالا تر است زیرا تبدیل انرژی شیمیایی به انرژی الکتریکی به طور مستقیم و بدون واسطه انجام می شود .
سوزاندن گاز هیدروژن در موتور درون سوز، بازدهی نزدیک به 20 درصددارد در حالی که اکسایش آن در سلول سوختی بازده را تا سه برابر افزایش می دهد .
رایج ترین سلول سوختی، سلول هیدروژن اكسیژن است. دستگاهی كه در آن گاز هیدروژن با گاز اکسیژن به صورت کنترل شده واکنش می دهد و بخش قابل توجهی از انرژی شیمیایی به انرژی الکتریکی تبدیل می شود .
وجه اشتراک سلول سوختی و باتری این است که هر دو نوعی سلول گالوانی محسوب شده و به کمک واکنش های اکسایش کاهش جریان برق را تولید می کنند و تفاوت آنها این است که سلول سوختی بر خلاف باتری انرژی شیمیایی را ذخیره نمی کند .
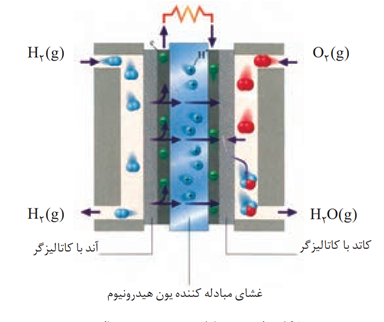
گاز هیدروژن در سلول سوختی نمی سوزد بلکه به آرامی اکسید می شود .
غشای مبادله کننده یون هیدروژن نقش الکترولیت دارد و به یون های هیدروژن اجازه عبور می دهد اما گاز اکسیژن و هیدروژن نمی توانند از آن عبور کنند .
بخار آب تولید شده از قسمت پایین سلول که مجاور قطب مثبت (کاتد) است خارج می شود . تنها بخشی از گاز هیدروژنی که وارد سلول سوختی می شود در نیم واکنش آندی شرکت می کند که بخش دیگر از قسمت زیرین سلول سوختی خارج می شود .
نیم واکنش کاتدی با آزاد شدن مقدار قابل توجهی گرما همراه است و گرمای آزاد شده باعث می شود آب حاصل به صورت بخار در آید .
E°سلول برابر E° واکنش کاتدی است .
در سلول سوختی آند و کاتد که به غشای مبادله کننده هیدرونیوم چسبیده اند دارای کاتالیزگز هایی هستند که واکنش اکسایش و کاهش را سرعت می بخشند .

تعیین عدد اکسایش :
به ازای هر جفت الكترون پیوندی میان دو اتم یكسان، یك الكترون به هر اتم نسبت دهید.
همه الكترون های ناپیوندی روی هر اتم را به همان اتم نسبت دهید.
به ازای هر جفت الكترون پیوندی میان دو اتم متفاوت، هر دو الكترون را به اتم با خصلت نافلزی بیشتر نسبت دهید.
الكترون های نسبت داده شده به هر اتم را بشمارید و آن را از شمار الكترون های ظرفیت
همان اتم كم كنید. عدد به دست آمده عدد اكسایش اتم مورد نظر را نشان می دهد.
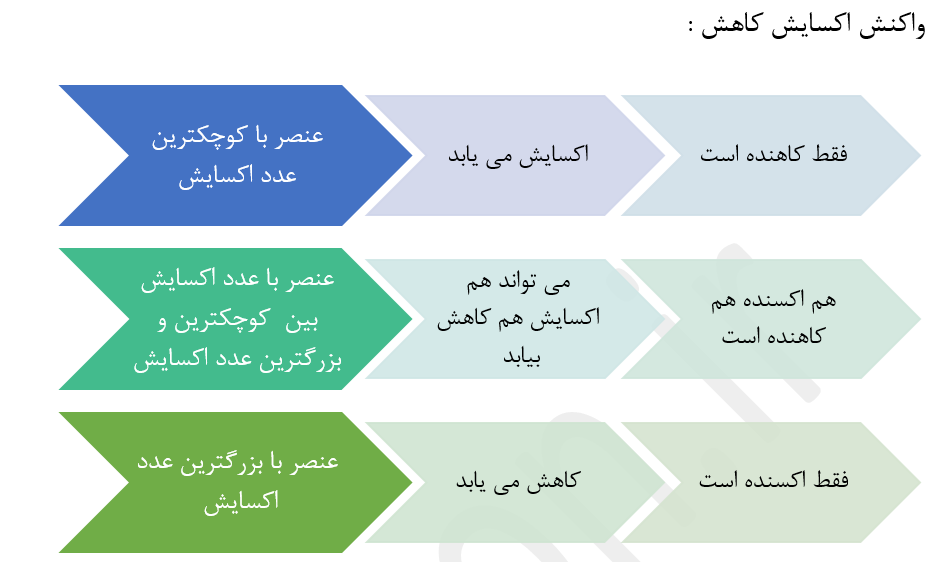
افزایش عدد اکسایش به معنای از دست دادن الکترون و فرایند اکسایش است در حالی که کاهش آن به معنای به دست آوردن الکترون و فرایند کاهش است.

موازنه نیم واکنش ها : ضریب الکترون را برابر تغییر عدد اکسایش اتم قرار می دهیم و سپس شمار اتم ها را موازنه می کنیم .
موازنه واکنش اکسایش کاهش : تغییر عدد اکسایش گونه اکسنده و کاهنده را محاسبه می کنیم . گر اتمی در سمت چپ واکنش مورد نظر زیروندی به غیر از یک داشته باشد، باید تغییر عدد اکسایش را در آن زیروند ضرب نمود. لازم به ذکر است که مقدار تغییر عدد اکسایش را بدون علامت در زیروند ضرب می کنند.مقدار کاهش عدد اکسایش را ضریب عنصر اکسید شده و به طور مشابه میزان افزایش عدد اکسایش را ضریب عنصر احیا شده قرار می دهند. توجه داشته باشید که ضرایب به گونه ای اضافه می شوند که در نهایت کاهش کل در عدد اکسایش با افزایش کل برابر شوند. زیرا شرط اصلی در یک واکنش اکسايش – کاهش این است که مجموع جبری تغيير در اعداد اکسايش برابر با صفر باشد.(واکنش نیتریک اسید با فلز ها در کنکور پرتکرار است و برای موازنه از روش اکسایش کاهش استفاده می کنیم)

سلو ل های الكترولیتی : از سلول های الكتروشیمیایی كه با اعمال یك ولتاژ بیرونی و عبور جریان الكتریكی از درون محلول الكترولیت می توان یك واكنش شیمیایی را در خلاف جهت طبیعی پیش راند.
در سلول های الکترولیتی بر خلاف سلول های گالوانی کاتد نقش قطب - و آند نقش قطب + را دارد و مانند سلول گالوانی کاتیون ها به سمت کاتد و آنیون ها به سمت آند مهاجرت می کنند و در مدار خارجی حرکت الکترون ها از آند به سوی کاتد است .
در سلول های الکتریکی آند و کاتد بودن ربطی به E° فلز ها ندارد و به این بستگی دارد که فلز ها به قطب مثبت یا منفی باتری متصل اند .
برقکافت :

آب خالص رسانایی الکتریکی ناچیزی دارد از این رو برای برقکافت آن باید اندکی الکترولیت به آب افزود .
در فرایند برقکافت پیرامون کاتد بین گونه های اکسنده برای گرفتن الکترون رقابت می شود و گونه ای در این رقابت برنده است که E° بزرگتری دارد و کاتیون های گروه 1 و2 و یون آلومینیوم دارای E° بسیار کوچکی هستند ، و کاتیون های ذکر شده در رقابت با مولکول های آب برای گرفتن الکترون بازنده هستند .
پیرامون آند گونه های کاهنده برای از دست دادن الکترون با یکدیگر رقابت می کنند و در این رقابت گونه ای برنده است که مربوط به نیم واکنشی با E° کوچکتر است ، یون فلوئورید و کلرید و آنیون های معروف اکسیژن دار مثل سولفات و فسفات در رقابت آندی با آب بازنده اند .
برای برقکافت آب ماده ای که به عنوان الکترولیت به آب خالص اضافه می کنیم باید در رقابت مولکول های آب بازنده باشد (مثل کاتیون های گروه یک و دو و کاتیون آلومینیوم)
آنیون ماده ای که به عنوان الکترولیت به آب خالص اضافه می کنیم باید در رقابت مولکول های آب بازنده باشد (مثل یون کلرید و فلوئورید و بنیان های اکسیژن دار)

در سلول الكترولیتی، دو الكترود درون یك الكترولیت قرار دارند، الكترودهایی که اغلب گرافیتی هستند. در این سلول ها ، كاتد الکترودی است که به قطب منفی باتری و آند به قطب مثبت باتری متصل است و الكترولیت محتوی یون هایی است كه آزادانه جابه جا می شوند.
الكترولیت، یك محلول یونی یا یك تركیب یونی مذاب است. هنگامی که به این سلول ولتاژ معینی اعمال شود، یون ها به سوی الكترود با بار ناهمنام حركت می كنند. به طوری كه كاتیون ها به سوی كاتد و آنیون ها به سوی آند روانه می شوند تا به سطح الكترودها برسند و در نیم واكنش اكسایش و کاهش شركت كنند.
فلز سدیم یك كاهنده قوی است كه در طبیعت به حالت آزاد یافت نمی شود، عنصری كه در تركیب های طبیعی و گوناگون خود تنها به شكل یون سدیم وجود دارد . یون های سدیم بسیار پایدارتر از اتم های آن هستند. به همین دلیل برای تهیه فلز سدیم باید انرژی زیادی مصرف كرد .
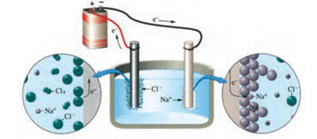
دیگر فلزهای فعال نیز كاهنده های قوی هستند، باید آنها را همانند سدیم از برقكافت نمك مذاب آنها تهیه كرد .
سدیم کلرید خالص در دمای 801 درجه سانتی گراد ذوب می شود. افزودن مقداری کلسیم کلرید به آن، دمای ذوب را تا 587 درجه سانتی گراد پایین می آورد .
در برقکافت سدیم کلرید حالت فیزیکی یون های کلرید و سدیم مذاب است نه محلول (غلظت هم برای آنها مطرح نمی شود)
در برقکافت سدیم با اینکه یون های کلسیم حضور دارند فلز کلسیم به دست نمی آید بنابراین کلسیم کاهنده تر از سدیم است و E° آن کمتر است .
چگالی منیزیم مذاب از چگالی منیزیم کلرید مذاب کمتر است .
چون الکترولیت مذاب است غلظت یون ها در آن بی تغییر است .
ظرف نقره ای در اثر انجام واکنش های اکسایش کاهش کدر می شود یا جلا می یابد .
خوردگی به فرایند ترد شدن، خرد شدن و فروریختن فلزها بر اثر واکنش اکسایش کاهش گفته می شود .
فلز هایی که اکسید می شوند ولی لایه نازک و چسبنده ایجاد می کنند و خورده نمی شوند :
تیتانیم ، کروم ، قلع ، آلومینیوم ، روی ، وانادیم ، نیکل
آهن پر مصرف ترین فلز در جهان است، خوردگی آن خسارت های هنگفتی به اقتصاد كشورها وارد میكند به طوری که سالانه حدود 20 درصد از آهن تولیدی برای جایگزینی قطعه های خورده شده مصرف می شود .
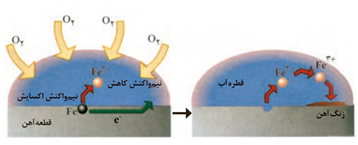
پتانسیل كاهشی اغلب فلزها منفی بوده اما پتانسیل كاهشی اكسیژن مثبت است. با این توصیف اكسیژن به عنوان اكسنده تمایل دارد با گرفتن الكترون از فلزها، آنها را اكسید كند.
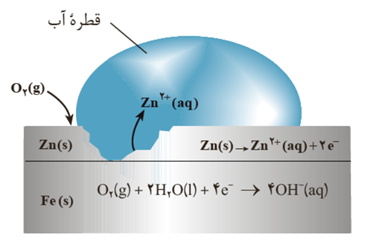
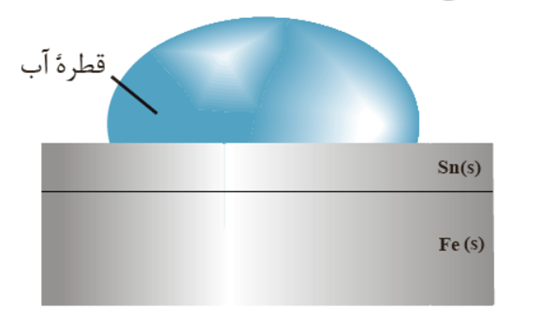
قطره آب نقش الکترولیت را دارد .
طرفیت قطره آب محل نیم واکنش کاتدی .
به دلیل تشکیل یون هیدروکسید پی اچ در کاتد افزایش می یابد .
قطره آب محل رفت و آمد یون هاست نه الکترون ها و الکترون ها از طریق خود آهن به سمت کاتد مهاجرت می کنند .
زیر قطره آب که اکسیژن هوا کم است بخش آندی است .

از آنجا که E° برای نیم واکنش کاتدی در محیط اسیدی بزرگتر از محیط غیر اسیدی است ، در محیط اسیدی مولکول های اکسیژن برای گرفتن الکترون در محیط اسیدی تمایل بیشتری دارد و خوردگی فلز ها در محیط اسیدی بیشتر رخ می دهد .
E° فلز هایی مانند طلا و پلاتین از E° واکنش کاتدی فرایند خوردگی چه در محیط اسیدی چه بازی بزرگتر است بنابراین مولکول های اکسیژن و آب در هیچ شرایطی نمی توانند از اتم های طلا و پلاتین الکترون بگیرند .
در فرایند خوردگی آهن با اکسیژن در محیط اسیدی نیم واکنش کاهش یون هیدروکسید تولید نمی شود ، در این حالت زنگ آهن تولید نشده و به جای آن محلولی از یون های آهن و آنیون های اسید ایجاد می شود مثلا اگر اسید HCl باشد FeCl3 تولید می شود .
وجود محیط اسیدی و نمک های محلول و قرار دادن آهن در مجاورت فلزی با E° بیشتر از آهن باعث افزایش سرعت خوردگی آهن می شود .
ساده ترین راه برای جلوگیری از خوردگی آهن ، ایجاد یك پوشش محافظ است تا از رسیدن اكسیژن و رطوبت به آهن جلوگیری کند. پوششی كه با روش هایی مانند رنگ زدن، قیراندود كردن و روكش دادن ایجاد می شود. باید توجه داشت كه چنین روش هایی نمی توانند به طور كامل از خوردگی پیشگیری كنند زیرا به تدریج رطوبت و اكسیژن از روزنه های این پوشش ها به درون نفوذ كرده و به سطح آهن می رسند و خوردگی دوباره آغاز می شود.
هنگامی که دو فلز در هوای مرطوب با هم در تماس باشند، برای اكسایش یافتن با یكدیگر رقابت می كنند. بدیهی است كه فلز كاهنده تر در این رقابت برنده می شود.
 فداكاری فلز روی برای حفاظت از آهن سبب شد تا در صنعت ورقه های آهنی با پوششی از فلز روی تهیه شود. این نوع آهن به آهن گالوانیزه(آهن سفید) معروف است و در ساخت تانكر آب، كانال كولر و... به كار می رود.
فداكاری فلز روی برای حفاظت از آهن سبب شد تا در صنعت ورقه های آهنی با پوششی از فلز روی تهیه شود. این نوع آهن به آهن گالوانیزه(آهن سفید) معروف است و در ساخت تانكر آب، كانال كولر و... به كار می رود.
عوامل اکسنده الکترون ها را از سطح آهن دریافت می کنند .
روی آند و آهن کاتد می باشد .

شکل بخشی از یک ورقۀ آهنی را نشان می دهد که با لایۀ نازکی از قلع پوشیده شده است. به این نوع آهن، حلبی می گویند. از ورقه های حلبی برای ساختن قوطی های روغن نباتی و کنسرو استفاده می شود .
آهن سفید بر خلاف آهن حلبی حفاظت کاتدی برای آهن دارد و قوطی هایی از جنس حلبی در اثر خراش زودتر و آسان تر دچار خوردگی می شوند.
آهن آند و قلع کاتد می باشد .
الکترون های حاصل از اکسایش آهن به سطح قلع منتقل و در آنجا مولکول های اکسیژن و آب نیم واکنش کاتدی را انجام می دهند .
با اینکه آهن سفید در برابر زنگ زدن مقاوم است و حلبی در برابر زنگ زدن آسیب پذیر است اما برای ساختن قوطی های کنسرو مواد خوراکی و کمپوت ها از حلبی استفاده می شود چون اسید میوه و اسید های خوراکی بر قلع اثر نمی کنند و مواد خوراکی برای مدت بیشتری محفوظ می باشند اما اگر این قوطی ها را با آهن سفید بسازیم اسید های موجود در مواد غذایی با روی واکنش داده و موجب فاسد شدن مواد غدایی می شود .
خوردگی فلزهی مس وآهن از یک سو سبب از بین رفتن زیبایی وسیله می شود و از سوی دیگر به سلامتی بدن آسیب می رساند. به همین دلیل، سطح اغلب این وسایل فلزی را با فلزهایی مانند نقره، كروم، نیكل و طلا می پوشانند .
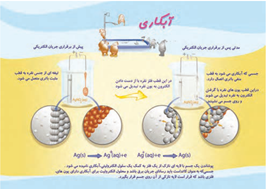
پوشاندن سطح یك فلز با لایه نازكی از فلزهای ارزشمند و مقاوم در برابر خوردگی، آبكاری نام دارد.
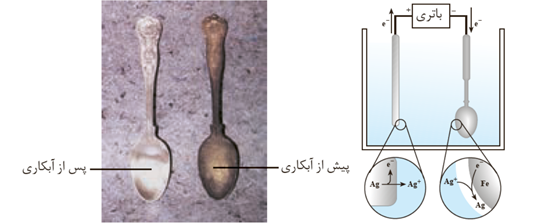
جسمی که قرار است روکش فلزی روی آن ایجاد شود باید در نقش کاتد و رسانای برق باشد . و فلزی که قرار است روی جسم مورد نظر بشیند باید در نقش آند قرار گیرد .
الکترولیت باید شامل کاتیون های فلزی باشد که قرار است روی جسم بنشیند .
آبکاری از طرق سلول الکترولیتی انجام می شود .
غلظت الکترولیت تقریبا ثابت می باشد .
تشخیص سلول گالوانی از الکترولیتی :
اگر در شکل مربوطه منبع جریان یا باتری دیده شود سلول الکترولیتی می باشد .
تولید نیترو اسید از N2O3 اکسایش کاهش و تولید نیتریک اسید از N2O5 اکسایش کاهش نیست .
آلومینیم فلزی فعال است كه به سرعت در هوا اكسید می شود از ادامه اكسایش جلوگیری میکند به طوری كه لایه های Al2O3 فلز با تشكیل لایه چسبنده و متراكم زیرین برای مدت طولانی دست نخورده باقی می ماند و استحكام خود را حفظ میکند. این ویژگی آلومینیم سبب شده كه از آن در ساخت لوازم خانگی ، هواپیما، كشتی و ... استفاده كرد .
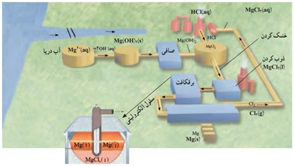
آلومینیم همانند دیگر فلزهای فعال در طبیعت به شكل تركیب یافت می شود از این رو این فلز هم از برقكافت نمک های مذاب آن به دست می آید. رایج ترین روشی كه به فرایند هال معروف است . چارلز مارتین هال (شیمی دان آمریکایی) در 23 سالگی این روش را ابداع کرد .

برای فرایند برقکافت از منبع جریان مستقیم استفاده می شود .
برای تهیه آلومینیوم نمی توان از برقکافت محلول نمک های آن در آب استفاده کرد .
دیواره ها و کف از جنس گرافیت و نقش کاتد را دارند .
میله های گرافیتی در بالای دستگاه به قطب مثبت متصل اند و نقش آند را دارند .
چگالی آلومینیوم مذاب نسبت به چگالی الکترولیت مذاب بیشتر بوده .
چون الکترولیت مذاب است غلظت یون ها در آن بی تغییر خواهد بود .
پیرامون آند دو عنصر اکسایش می یابد ابتدا یون های اکسید به گاز اکسیژن اکسایش یافته و سپس گاز اکسیژن با کربن موجود در آند واکنش داده و به کربن در اکسید تبدیل می شود .
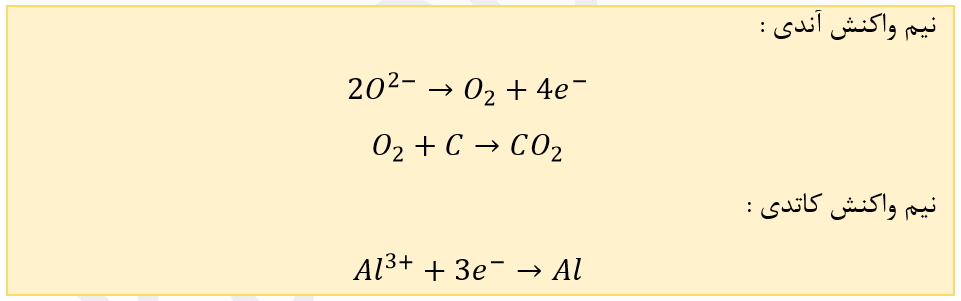
فرایند هال به علت مصرف مقدار زیادی انرژی الکتریکی هزینۀ بالایی دارد؛ از این رو با بازیافت فلز آلومینیم می توان ضمن افزایش عمر یکی از مهم ترین منابع تجدید ناپذیر طبیعت، برخی از هزینه های تولید این فلز را کاهش داد. برای نمونه تولید قوطی های آلومینیمی از قوطی های کهنه فقط به 7درصد از انرژی لازم برای تهیۀ همان تعداد قوطی از فرایند هال نیاز دارد.
به جرم مواد موجود در بخش آندی افزوده می شود (ناشی از افزوده شدن اتم های اکسیژن)
پی اچ اطراف آند کمتر از 7 و اطراف کاتد بیشتر 7 می باشد .
emf ، بازده و سرعت انجام واکنش در این سلول پایین است .
مزیت آن استفاده از انرژی های پاک و تجدید پذیر است و آلایندگی ندارد .
برای حل ویدیویی تست های کنکور کلیک کنید.
✨برای عضویت در کانال کانون برتر ها کلیک کنید✨


