توجه:
شما با مطالعه این درسنامه می توانید به سوالات 801-820از کتاب نوروز و سوالات 87،102،109،110،279،281،439،448،449،455،618،622،755،765،777،778،927،931،933،1078،1084،1085،1086،1234،1238،1240،280،619 از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
دانش آموزان عزیز سلام .
در این مطلب قصد داریم خلاصه نکات فصل دو شیمی دوازدهم را به همراه سوالات نهایی و کنکور در اختیار شما قرار دهیم .
درسنامه شامل : خلاصه مطالب و نکات 5 تست کنکور سال های اخیر سوالات نهایی مربوطه |  |
در ابتدا سوالات نهایی را بررسی می کنیم .
- هر سلول گالوانی ولتاژ معینی دارد ، اما با تغییر هر یک از اجزای سلول ولتاژ تغییر می کند . درست
- با توجه به نیم واکنش های مقابل به سوالات پاسخ دهید .

آ)در سلول گالوانی مس نقره کدام فلز نقش آند را ایفا می کند ؟
ب)در این سلول گالوانی به گذشت زمان جرم کدام تیغه افزایش پیدا می کند ؟
پ)emf این سلول را حساب کنید .
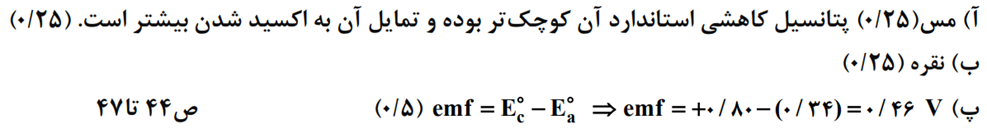
با توجه به واکنش های زیر پاسخ دهید .
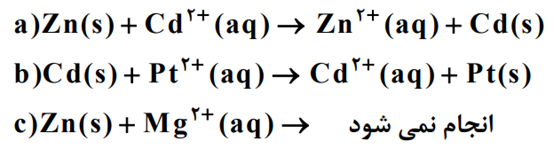
آ)گونه های اکسنده و کاهنده را در واکنش a را مشخص کنید .
ب)آیا با قرار دادن تیغه پلاتینی درون محلولی از یون های منیزیم واکنش انجام می شود؟ چرا؟

- در میان فلز ها ، کمترین °E کاهشی را (لیتیم / پتاسیم) دارد .
- پتانسیل کاهشی استاندارد برخی نیم سلول ها در جدول داده شده است :
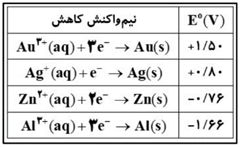
با قرار دادن کدام فلز درون محلول محتوی دمای محلول تغییر نمی کند ؟
در شرایط یکسان ، قدرت کاهندگی کدام گونه بیشترین است ؟
درسنامه :
- برای ایجاد جریان الكتریكی باید الكترون ها را از یك مسیر معین عبور داد یا از نقطه ای به نقطه دیگر جابه جا نمود .
- اگر به جای داد و ستد مستقیم الكترون بین گونه های اکسنده و كاهنده در یك واكنش، بتوان الكترون ها را از طریق یك مدار بیرونی هدایت و جابه جا كرد آنگاه می توان بخشی از انرژی آزاد شده در واكنش اكسایش كاهش را به شكل انرژی الكتریكی در دسترس تبدیل نمود.
- نیم سلول : الکترودی که در یک محلول الکترولیت قرار دارد .
- یک سلول گالوانی همچون دستگاهی عمل میکند که به طور همزمان، واکنشهای اکسایش و کاهش در آن روی میدهند. از این واکنشها برای تبدیل انرژی شیمیایی به انرژی الکتریکی استفاده میشود (بر اساس قدرت كاهندگی فلز ها)
- واکنش سلول های گالوانی با کاهش آنتالپی همراه است اما انرژی آزاد شده به صورت انرژی الکتریکی در اختیار ما قرار می گیرد نه به صورت گرما .
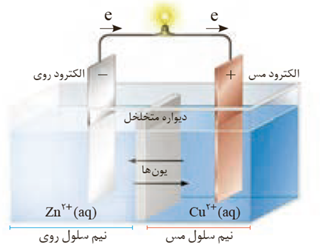
- آند الكترودی است كه در آن نیم واکنش اكسایش و كاتد الكترودی است كه در آن نیم واکنش كاهش رخ می دهد.
- در مدار بیرون حرکت الکترون ها از آند به سمت کاتد است .
- به دلیل تولید الكترون درالكترود آند ، آن را با علامت منفی نشان می دهند.
- برای ادامه واكنش اكسایش كاهش، محلول های موجود در هر دو ظرف باید از نظر بار الکتریکی خنثی بمانند. این مهم هنگامی امكان پذیر است كه كاتیون ها از نیم سلول آند به كاتد و آنیون ها از نیم سلول كاتد به آند با گذر از دیواره متخلخل مهاجرت كنند.
- نیروی الكتروموتوری (emf): اختلاف پتانسیل میان دو نیم سلول است .
°Eآند - °Eکاتد = emf
- اندازه گیری پتانسیل یك نیم سلول به طور جداگانه ممكن نیست و باید این كمیت به طورنسبی اندازه گیری شود .
- نیم سلول استاندارد هیدروژن (SHE) را به عنوان مبنا انتخاب شد و پتانسیل آن را برابر با صفر در نظر گرفتند. در ادامه با تشكیل سلول گالوانی از هر نیم سلول با SHE توانستند پتانسیل بسیاری از نیم سلول ها را اندازه بگیرند . پتانسیل اندازه گیری شده را پتانسیل استاندارد نیم سلول می نامند. (این اندازه گیری ها در دمای 25 درجه ، فشار یک atm و غلظت یک مولار برای محلول الکترولیت ها انجام شده است) .
- افزایش دما و افزایش غلظت واکنش دهنده ها اختلاف پتانسیل سلول گالوانی افزایش پیدا می کند .
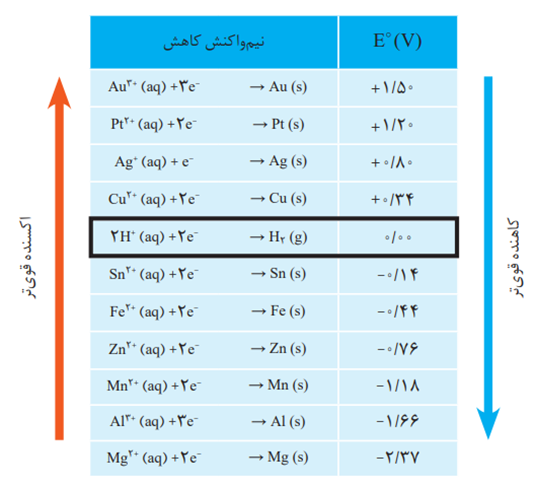
- رتبه بندی فلز ها بر اساس °E آنها در یک جدول سری الکتروشیمیایی نامیده می شود .
- نیم واکنش ها به شكل كاهش نوشته شده اند و این پیشنهاد آیوپاك برای هماهنگی در همه منابع علمی معتبر به کار می رود.
- اگر ضرایب نیم واکنش را در عددی ضرب کنیم °E بی تغییر باقی می ماند .
- گونه ای که سمت چپ تعادل مربوط به یک الکترود استاندارد قرار دارد اکسنده و گونه ای که سمت راست قرار دارد کاهنده است و هنگامی که صحبت از مقایسه قدرت اکسندگی می شود باید مواد سمت چپ را و هنگامی که کاهندگی مورد مقایسه قرار می گیرد باید مواد سمت راست را با یکدیگر مقایسه کنیم .
- واکنش بین گونه سمت چپ از نیم واکنش بالاتر و گونه سمت راست از نیم واکنش پایین تر انجام پذیر است .
- محلول نمک یا کاتیون یک فلز را باید در ظرفی از جنس فلز بالاتر نگهداری کرد .
- علامت °E فلزهایی که قدرت کاهندگی بیشتری از 2H دارند، منفی و علامت °E فلزهایی که قدرت کاهندگی کمتری از 2H دارند، مثبت است .
- اسید هایی مثل HCl ، HBr و .. بر فلز هایی از جدول که °E مثبت دارند بی اثر اند .
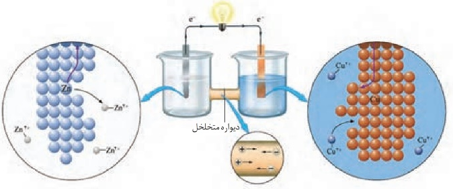
- الکترودی که °E منفی تری دارد آند (قطب منفی) سلول گالوانی را تشکیل می دهد و واکنش اکسایش در آن انجام می گیرد .
- الکترودی که °E مثبت تری دارد کاتد (قطب مثبت) سلول گالوانی را تشکیل می دهد و واکنش کاهش در آن انجام می گیرد .
- از جرم فلز آند کاسته و به جرم فلز کاتد افزوده می شود.
- غلظت کاتیون ها در بخش کاتدی به مرور کم و در بخش آندی به مرور زیاد می شود .
- با انجام واکنش به تدریج سطح کاتد دارای بار مثبت و سطح آند دارای بار منفی می شود .
- هر چه °E دو نیم سلول در جدول از یکدیگر فاصله بیشتری داشته باشد اختلاف پتانسیل آنها بیشتر شده و ولتاژ سلول حاصل بزرگتر خواهد شد . و واکنش با میل و شدت بیشتر انجام شده و گرمای بیشتری آزاد می شود و تغییر دما محلول شدیدتر خواهد بود .
- آنیون به سمت آند مهاجرت می کند و کاتیون به سمت کاتد مهاجرت می کند .

- باتری ها در شكل، اندازه و كارایی با یكدیگر تفاوت آشكاری دارند اما در همه آنها با انجام شدن نیم واکنش های آندی و كاتدی، جریان الكتریكی در مدار بیرونی برقرار می شود.
- لیتیم در میان فلزها، كمترین چگالی و°E را دارد. این ویژگی های لیتیم سبب شد راه برای ساخت باتری های سبكتر، كوچكتر وبا توانایی ذخیره بیشتر انرژی هموار شود.
- باتری های لیتیمی از نوع دگمه ای در شكل ها و اندازه های گوناگون به کار می رود. دسته ای دیگر از باتری های لیتیمی آنهایی هستند كه درتلفن و رایانه همراه به كار می روند و می توان آنها را بارها شارژ كرد .
- همه باتری های دگمه ای لیتیمی نیستند ( باتری روی نقره )
- پسماندها ی الکترونیکی به دلیل داشتن مواد شیمیایی گوناگون، سمی هستند و نباید در طبیعت رها یا دفن شوند زیرا :
1.محیط زیست را آلوده می کنند.
2.از سوی دیگر برخی از این پسماندها به دلیل داشتن مقدار قابل توجهی از مواد و فلزهای ارزشمند و گران قیمت، منبعی برای بازیافت این مواد هستند .
- فلز پلاتین به علت پتانسیل کاهشی بالایی که دارد و در واکنش ها اکسایش نمی یابد و واکنش پذیری کم آن در بخش های مختلف بدن هنگام جراحی به کار می رود .
- فلوئور نافلزترین عنصر جدول است و تمایل آن برای گرفتن الکترون زیاد است به همین دلیل اکسنده ترین عنصر جدول است .

- برای مشاهده حل ویدیویی تست ها اینجا کلیک کنید.
- ❤عضویت در کانال کانون برتر ها❤


