توجه:
شما با مطالعه این درسنامه می توانید به سوالات 801-820 از کتاب نوروز و سوالات 87،102،109،110،279،281،439،448،449،455،618،622،755،765،777،778،927،931،933،1078،1084،1085،1086،1234،1238،1240،280،619از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
دانش آموزان عزیز سلام
در این مطلب قصد داریم نکات مباحث ابتدایی فصل دو شیمی دوازدهم را به همراه سوالات نهایی و کنکور در اختیار شما قرار دهیم تا آمادگی لازم را برای آزمون کسب کنید .
 | رویا خواجوی رتبه 8 منطقه سه ، کنکور تجربی 1403 دانشجوی دندانپزشکی شهید بهشتی |
درسنامه شامل :
خلاصه مطالب و نکات
5 تست کنکور سال های اخیر
سوالات نهایی مربوطه
در ابتدا سوالات نهایی مرتبط با مبحث را بررسی می کنیم .
●اغلب نافلز ها در واکنش با فلز ها نقش (اکسنده/کاهنده) دارند .
●فلز ها اغلب به عنوان کاهنده هستند. درست
● با توجه به واکنش های زیر به پرسش ها پاسخ دهید
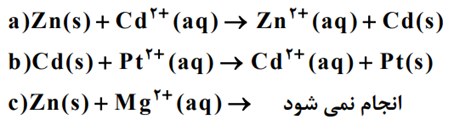
آ) گونه های اکسنده و کاهنده را در واکنش a مشخص کنید .
ب)آیا با قرار دادن تیغه پلاتینی درون محلولی از یون های منیزیم واکنش انجام می شود؟ چرا؟

●شکل زیر نمایی از واکنش روی با هیدروکلریک اسید را نشان می دهد . 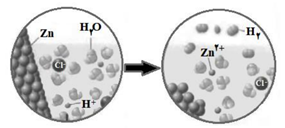
آ) کدام گونه اکسایش یافته است؟ چرا؟
ب) نیم واکنش کاهش را بنویسید و موازنه کنید .
پ) گونه اکسنده را تعیین کنید .

●با توجه به شکل زیر که الگوی ساده ای از واکنش بین اتم های آهن و اکسیژن را با ساختار لایه ای نشان می دهد به پرسش ها پاسخ دهید .
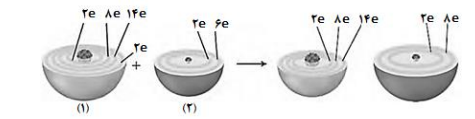
آ) کدام ساختار 1 یا 2 اتم آهن را نشان می دهد؟
ب) کدام گونه (آهن یا اکسیژن) اکسایش یافته است؟
پ) کدام گونه اکسنده است؟ دلیل بنویسید.
ت) هر گاه به جای آهن از پلاتین استفاده شود ، آیا واکنشی انجام می شود؟ چرا؟

درسنامه :
● پدیده های طبیعی همچون تندر و آذرخش نشان می دهند که انرژی ممکن است به شکل انرژی الکتریکی میان سامانه واکنش و محیط پیرامون جاری شود . پدیده هایی از این دست که از ماهیت الکتریکی ماده سرچشمه می گیرند سبب شد تا تلاش برای شناسایی واکنش های شامل داد و ستد الکترون به شکل هدفمند دنبال شود . این واکنش ها مبنای تولید انرژی الکتریکی هستند .
● تولید انرژی الکتریکی پاک و ارزان دستاوردی از دانش الکتروشیمی است . الکتروشیمی افزون بر تهیه مواد جدید به کمک انرژی الکتریکی می تواند در راستای پیاده کردن اصول شیمی سبز گام بردارد .
● تامین روشنایی ، گرمایش و سرمایش آسان تر ، حمل و نقل سریع تر و ایمن تر ، درمان و کاهش اثر نقص عضو و انتقال آب آشامیدنی نیم رخی از افزایش سطح رفاه و آسایش را نشان می دهد .
● دو رکن اساسی تحقق این فناوری ها : دستیابی به مواد مناسب و تامین انرژی است .
● پرکاربرد ترین شکل انرژی در به کارگیری این فناوری ها انرژی الکتریکی است .
الکتروشیمی شاخه ای از شیمی است که در بهبود خواص مواد و تامین انرژی نقش بسزایی دارد .
● باتری یکی از فراورده های مهم صنعتی است که در محل مورد نیاز با انجام واکنش های شیمیایی الکتریسیته تولید می کند . باتری، مولدی است كه در آن واكنش های شیمیایی رخ میدهد تا بخشی از انرژی شیمیایی مواد به انرژی الكتریكی تبدیل شود .
● از سوی دیگر ساخت لوله های فلزی انتقال آب، قوطی های محتوی مواد غذایی، لوازم آشپزی كه در برابر خوردگی مقاوم هستند و مانع از آلوده شدن آب و مواد غذایی می شوند، همچنین كسب اطمینان از كیفیت تولید فراورده های دارویی، بهداشتی، غذایی و... چهره های دیگر از افزایش سطح رفاه و آسایش هستند. دستیابی به این موفقیت ها در گرو بهره گیری از دانش الكتروشیمی است .
● از راه های بهره گیری از انرژی ذخیره شده در فلزها، اتصال آنها در شرایط مناسب به یكدیگر است. برای نمونه با یك تیغه مسی و تیغه ای دیگر مانند روی و با میوه ای مانند لیمو میتوان نوعی باتری ساخت و با آن یك لامپ ال ای دی را روشن کرد . (تیغه مس نقش کاتد و تیغخ روی نقس آند را دارد)
●چراغ خورشیدی یک ابزار روشنایی است که از لامپ ال ای دی سلول خورشیدی و باتری قابل شارژ تشکیل شده است .
● گرفتن الكترون را كاهش و از دست دادن الكترون را اكسایش می نامیم .
● شیمیدان ها هریک از فرایندهای گرفتن و از دست دادن الکترون را با یک نیم واکنش نمایش می دهند كه هر نیم واکنش باید از لحاظ جرم و بار الكتریكی موازنه باشد .
● نیم واکنش اکسایش کاهش به صورت همزمان صورت می گیرد .
اکسایش: از دست دادن الکترون
کاهش : به دست آوردن الکترون
● ماده ای که با گرفتن الکترون سبب اکسایش گونه دیگر می شود اکسنده و ماده ای که با دادن الکترون سبب کاهش گونه دیگر می شود کاهنده نام دارد .
● اغلب فلزها در واکنش با نافلزها تمایل دارند یک یا چند الکترون خود را به نافلزها داده و ضمن اکسایش به کاتیون تبدیل شوند نافلزها نیز با گرفتن یك یا چند الکترون کاهش یافته و به آنیون تبدیل می شوند. از این رو فلزها اغلب كاهنده و نافلزها اغلب اكسنده هستند .
●واکنشی که در آن دست کم عدد اکسایش یک عنصر تغییر کرده باشد واکنش اکسایش کاهش نام دارد . اگر در سمتی از معادله یک واکنش شیمیایی عنصری با حالت آزاد وجود داشته باشد آن واکنش مسلما از نوع اکسایش کاهش است .
● در واکنش های اکسایش کاهش که به صورت طبیعی انجام می شوند پایداری فراورده ها از واکنش دهنده ها بیشتر بوده و واکنش گرماده است .
● واکنش سوختن هر عنصر یا ترکیب آلی از واکنش های اکسایش کاهش است .
●برای نمونه هرگاه تیغ هایی از جنس روی درون محلول مس (II) سولفات آبی رنگ قرار گیرد به تدریج از رنگ محلول کاسته می شود که نشان دهنده انجام واکنش زیر است . (محلول روی سولفات بی رنگ و محلول مس (II) سولفات آبی رنگ است)
●اتم های روی با از دست دادن دو الکترون به یون های روی اکسایش یافته و همزمان با آن هر یون مس با دریافت همان دو الکترون به اتم مس کاهش می یابد در واکنش هایی از این دست فراورده ها پایدار تر از واکنش دهنده ها هستند . بنابراین واکنش انجام شده گرما ده است و گرمای آزاد شده باعث می شود دمای نهایی محلول از دمای اولیه آن بالاتر باشد . تغییر دمای محلول نشان دهنده انجام واکنش است.
●اغلب فلزها در واكنش با محلول اسیدها، گاز هیدروژن و نمك تولید می كنند .
●در این واکنش اتم های روی الکترون از دست می دهند و اکسایش می یابند و سبب کاهش یون های هیدروژن می شوند ، از این رو اتم های روی نقش کاهنده دارند در حالی که یون های هیدروژن ، الکترون به دست می آورند و کاهش می یابند و سبب اکسایش اتم های روی می شوند، از این رو یون های هیدروژن نقش اکسنده دارند .
●در گذشته برای عکاسی از سوختن منیزیم به عنوان منبع نور استفاده می شد. در این واکنش منیزیم با نور خیره کننده ای در اکسیژن می سوزد و به منیزیم اکسید تبدیل می شود . منیزیم اکسایش یافته و کاهنده است و اکسیژن کاهش یافته و اکسنده است .
●هر اتم آلومینیم سه الكترون از دست می دهد و اكسایش می یابد درحالی كه هر یون مس دو الكترون می گیرد و كاهش می یابد . 6 الکترون میان اتم های آلومینیوم و یون های مس داد و ستد می شود .
●اگر قدرت کاهندگی فلز A از قدرت کاهندگی فاز B بیشتر باشد قدرت اکسندگی کاتیون حاصل از A کمتر از قدرت اکسندگی کاتیون حاصل از فلز B خواهد بود .
●تیغه مس در محلول روی سولفات پس از مدت طولانی تغییری نمی کند .
●اگر منیزیم را در محلولی از کلسیم کلرید قرار دهیم دمای نهایی بیشتر از دمای اولیه است ، درست است که با کلسیم کلرید واکنش نمی دهد اما منیزیم با آب واکنش می دهد .
● تمایل فلزها برای از دست دادن الكترون در محلول های آبی یكسان نیست . در یك واكنش اكسایش ــ كاهش، فلزی كه قدرت كاهندگی بیشتری دارد، میتواند با برخی كاتیون های فلزی واكنش دهد و آنها را به اتم های فلزی بكاهد . در این واکنش ها مخلوط واكنش گرم تر می شود زیرا سامانه واكنش بخشی از انرژی خود را به شكل گرما به محیط می دهد .


