توجه:
شما با مطالعه این درسنامه می توانید به سوالات541-555 از کتاب نوروز دوازدهم و سوالات 94،259،95،430،599،600،761،908،909،1065،1068،1250 از کتاب زرد دوازدهم پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات فصل سوم شیمی 1 از صفحه ی 108 تا 116 مطابق با بودجه بندی آزمون 16 اردیبهشت که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل سوم در کنکور سال های اخیر
برای دستیابی به مطلب اول از فصل سوم مطابق با آزمون 16 اردیبهشت روی لینک زیر کلیک کنید:
فصل سوم - شیمی دهم - خلاصه نکات - نوید آرمات
انواع برهم کنش های بین مولکولی
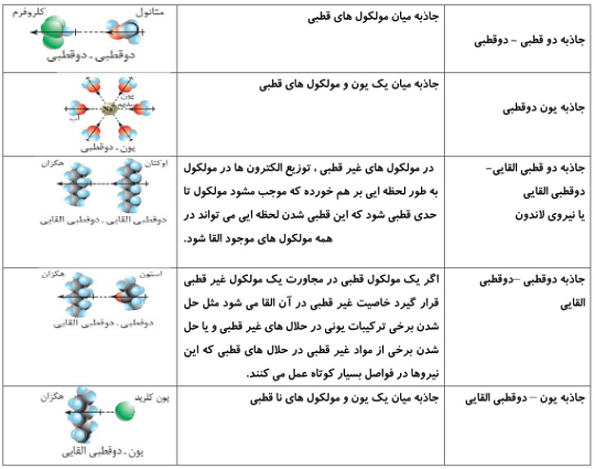

پیوند هیدروژنی
پیوند هیدروژنی از جمله نیروهای بین مولکولی قوی محسوب می شود. اما بیاد داشته باشیم که پیوند هیدروزنی از پیوندهای بین مولکولی است و مقایسه کردن آن با پیوند کووالانسی کار نادرستی است چرا که پیوند کووالانسی از جمله پیوندهاس درون مولکولی محسوب می شود و بسیار قوی می باشد.
پیوندی که مابین هیدروژن و عناصری که دو شرط زیر را داشته باشد، برقرار می شود:
شرط 1: الکترونگاتیویته زیاد شرط 2: شعاع اتمی کوچک
در بین عناصر جدول تناوبی 3 عنصر با این شرایط وجود دارد:
1) فلوئور F 2) اکسیزن O 3) نیتروزن N
در رابطه با قدرت پیوند هیدروژنی می توان گفت: H…..F > H…..O > H…..N
نکته بسیار مهم: موادی که دارای پیوند هیدروژنی هستند، نقطه جوش بالایی دارند.
شرط اینکه یک ترکیب بتواند پیوند هیدروزنی برقرار کند این است که آن ترکیب، هیدروژن متصل به 3 عنصر F یا O یا N داشته باشد.

رفتار های آب که با پیوند هیدروژنی توجیه می شود:
از آنجایی که آب دارای پیوند هدروژنی است ، این عامل سبب می شود که برخی رفتار های خاص در آب پدید آید که این رفتار ها عبارتند از:
۱) نقطه جوش آب به طور غیر عادی بالاست و نقطه انجماد آب به طور غیر عادی پایین است یعنی آب دیر به جوش می آید و هم دیر منجمد می شود.
۲) آب دارای پدیده کشش سطحی است و به همین علت سوزن بر سطح آب شناور می ماند و پای حشره در آب فرو نمی رود.
3) گرمای نهان تبخیر آب بالاست.
4) ظرفیت گرمایی ویژه آب زیاد است یعنی اینکه آب در برابر حرارت دیر تغییر دما می دهد.
۵) رفتار آب در برابر حرارت غیر عادی است، به طوریکه آب از 0 درجه سانتی گراد تا ۴ درجه سانتی گراد به طور غیر عادی تغير حجم می دهد، بطوریکه می توان گفت آب ۴ درجه دارای کمترین حجم و بیشترین جرم حجمی است.
حلال های مهم و انحلال پذیری در آن ها:
نکته: آب و اتانول در هر نسبتی در آب حل می شوند و نمی توان محلول سیر شده از آن ها تهیه کرد.
هگزان مانند اغلب هیدروکربن ها، دارای گشتاور دو قطبی ناچیز و در حدود صفر است. بنابراین ناقطبی بوده و در آب حل نمی شود. بنابراین مخلوط آّب و هگزان، مخلوطی ناهمگن است.

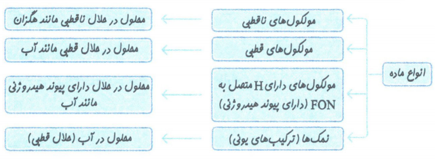
نکته: ترکیبات ناقطبی در حلال های قطبی و یا ترکیبات قطبی در حلال های ناقطبی حل نمی شوند.
فرآیند انحلال زمانی منجر به تشکیل محلول می شود که مقایسه نیروهای جاذبه به صورت زیر باشد:
میانگین جاذبه های حلال خالص و حل شونده خالص ≥جاذبه ی بین حل شونده و حلال در محلول
تشریح فرآیند انحلال ترکیبات مولکولی در آب:
1- جدا شدن مولکول های حل شونده از یکدیگر مثلا غلبه بر پیوند هیدروزنی بین مولکولهای شکر که فرآیندی گرماگیر است.
2- جدا شدن مولکول های حلال از یکدیگر مثلا غلبه بر پیوند هیدروژنی بین مولکول های آب که فرآیندی گرماگیر است.
3- ایجاد جاذبه متقابل جدید (برهمکنش جدید) بین ذرات حل شونده و حلال که فرآیندی گرماده است.
انحلال مولکولی:
به انحلال هایی که در آن ها مولکول های حل شونده از یک دیگر جدا شده و سپس به صورت همگن بین مولکول های حلال پخش می شوند، انحلال مولکولی گویند. مانند انحلال اتانول در آب، استون در آب، شکر در آب و یا ید در هگزان.
انحلال یونی:
در این فرآیند ساختار ماده ی حل شونده حفظ نمی شود و یون های سازنده ی بلور تفکیک و آب پوشیده می شوند، این فرآیند انحلال یونی به شمار می رود. مانند:

انحلال پذیری گاز ها:
انحلال پذیری گازها در آب به 3 عامل زیر وابسته است:
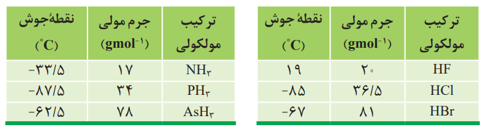
1- نوع گاز: گازهایی که دارای مولکول های قطبی هستند مانند 〖O_2,N〗_2 و.... در آب که حلال قطبی است، به میزان کمی حل می شوند. ولی گازهایی که دارای مولکول های قطبی هستند مانند N, HCl در آب به میزان بیشتری حل می شوند.
انحلال پذیری NO،N2،O2 در فشار ثابت در هر دمایی به صورت مقابل است: 
2- دما: انحلال پذیری گاز ها با دما رابطه ی عکس دارد. یعنی با افزایش دما، انحلال پذیری گازها کاهش می یابد و نمودار انحلال پذیری آن ها به صورت نزولی است.
3- فشار: بر طبق قانون هنری انحلال پذیری گازها با فشار رابطه مستقیم دارد. یعنی اگر در دمای ثابت، فشار افزایش داده شود، انحلال پذیری گازها در آب بیش تر می شود.
نکته: به طور کلی با افزایش فشار و کاهش دما، می توان انحلال پذیری یک گاز را در آب افزایش داد.


انحلال رساناها:
به طور کلی به موادی که می توانند جریان الکتریکی را به خوبی عبور دهند، رسانا گفته می شود که به دو دسته تقسیم می شوند:
1- رسانای الکترونی: فلز ها و گرافیت که به وسیله ی الکترون های آزاد خود، جریان را عبور می دهند، رسانای الکترونی نامیده می شوند.
2- رسانای یونی: محلول نمک ها و نمک های مذاب که به واسطه ی یون هایی که آزادانه حرکت می کنند جریان را عبور می دهند، رسانای یونی می گویند.
مواد الکترولیت و غیر الکترولیت
به موادی که بر اثر انحلال در آب، به طورکامل و یا به مقدار کم تفکیک شده و ایجاد یون می کنند، مواد الکترولیت گفته می شود و به محلول حاصل، محلول الکترولیت می گویند. مانند محلول نمک ها یا محلول برخی از ترکیبات قطبی در آب.
الکترولیت ضعیف: موادی هستند که به هنگام انحلال در آب بیش تر به صورت مولکولی حل شده و مقدار کمی از آن ها تفکیک می شوند. اسید ها و بازهای ضعیف مثل:HF, NH3
الکترولیت قوی: موادی هستند که به هنگام انحلال، به طور کامل به یون تفکیک می شوند. نمک ها، اسید ها و بازهای قوی مانند NaCl, HCl, KOH جز این دسته از مواد هستند.

متوسط – آزمون کانون قلم چی 1400


ساده – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400


متوسط – کنکور سراسری ریاضی 1400


متوسط – آزمون کانون قلم چی 1400


متوسط – آزمون کانون قلم چی 1400


ساده – آزمون کانون قلم چی 1400
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید.
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




