هوای آلوده شامل ترکیبات آلی اکسیژن دار مانند اتانال است. این مواد از واکنش هیدروکربنها با سایر گازهای موجود در هواکره تشکیل میشوند.
شکل1
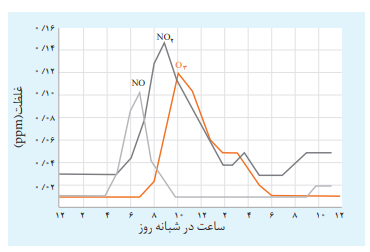
در درون اگزوز ماشین ها بدلیل گرمای بسیار زیاد ناشی از موتور واکنش زیر رخ میدهد
N2(g)+O2(g) →2NO(g)
بدلیل پایداری کم گاز تولید شده واکنش زیر رخ میدهد
2NO(g)+O2(g) →2NO2(g)
سپس در زیر نور خورشید گاز قهوه ای رنگ تولید شده به گاز اوزون تبدیل می شود
NO2(g)+O2(g)→NO(g)+O3(g)
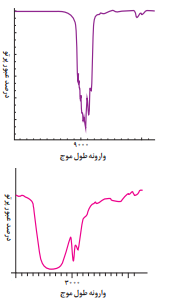
طیف سنجی فرو سرخ:یکی از رایجترین روشهای طیفسنجی که برای شناسایی گروههای عاملی بهکار میرود، طیفسنجی فروسرخ نام دارد. با توجه به اینکه شمار و نوع امتهای سازنده هر گروه عاملی متفاوت از دیگری است، هر یک از آنها تنها گستره معنی و منحصربه فردی از پرتوهای فروسرخ را جذب میکنند. همین تفاوت، اساس شناسایی گروههای عاملی از یکدیگر است.
شکل2
براساس این نمودار ها میتوان مشاهده کرد هر ماده چه طیف موج هایی را جذب کرده و چه طیف موج هایی را بازتاب میکند.
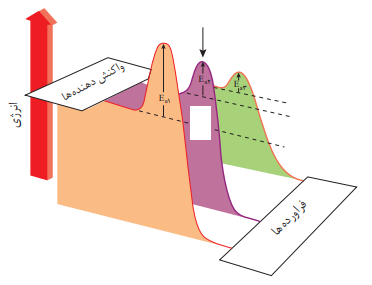
انرژی فعالسازی در واکنشهای شیمیایی
انرژی فعالسازی:هر واکنش شیمیایی برای شروع شدن نیازمند انرژی است انرژی فعالسازی انرژی مورد نیاز برای فعال شدن واکنش است.(بدون توجه به اینکه واکنش گرما ده یا گرما گیر است هر واکنش نیاز به انرژی برای شروع شدن دارد)
هنگامی که نوک کبریت روی سطح زیر قوطی کبریت کشیده شود، گرما تولید میشود. این گرما انرژی فعالسازی واکنش شیمیایی انجام شده را تأمین میکند.
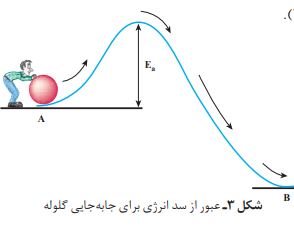
نکته:هرچه انرژی فعالسازی واکنشی بیشتر باشد، سرعت آن کمتر است.
با افزایش دما، انرژی واکنش دهنده ها بیشتر میشود. به طوری که شمار ذره هایی که در واحد زمان میتوانند به فراورده ها تبدیل شوند، افزایش یافته و در نتیجه سرعت واکنش افزایش می یابد.
نکته:از کاتالیزگر ها برای کاهش انرژی فعالسازی استفاده میشود. هر کاتالیزگر مخصوص چند واکنش است. با کاهش انرژی فعالسازی سرعت واکنش افزایش می یابد .
شکل4
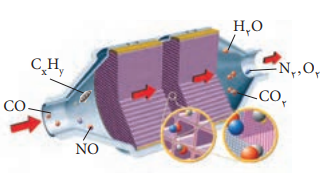
مبدل کاتالیستی: مجموعه چندکاتالیزگر است که در اگزوز ماشین ها قرار میدهند تا الایندهها در مسیر خروجشان از اگزوز به مدت کوتاهی با ان تماس داشته و به گاز های تمیزتر تبدیل شوند. در مسیر گاز های خروجی از خودرو ها قطعه ای قرار میدهند که میتواند باعث حذف یا کاهش الاینده- ها شود. مبدل کاتالیستی نامی است که به آن نسبت میدهند. بر روی سطح این قطعه سرامیکی که به شکل توری بکار می رود فلز های رودیم وپلاتین و پالادیم نشانده شده است برای افزایش کارایی مبدل کاتالیستی، گاهی سرامیک را به شکل مِش دانه های ریز درمیآورند و کاتالیزگرها را روی سطح آن مینشانند زیرا باعث افزایش سطح تماس الاینده ها با کاتالیزگر میشود.(Rh)(Pd)(Pt)
نکته: درسطح سرامیکهای درون مبدل کاتالیستی، توده های فلزی با قطر2تا 10 نانومتر وجود دارند.
شکل5
معیار های انتخاب کاتالیزگر درست:
1. در حضور کاتالیزگر نباید واکنشهای ناخواسته دیگری انجام شود.
2. کاتالیزگر در شرایط انجام واکنش باید پایداری شیمیایی و گرمایی مناسبی داشته باشد.
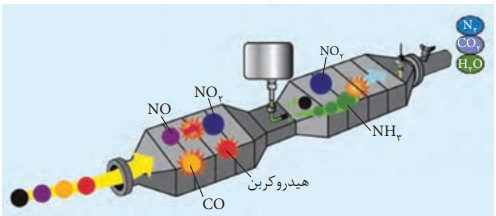
اما این مبدل مشکلی دارد و ان این است که نمیتواند نیتروژن دی اکسید و نیتروژن اکسید را به گازهای سالم تر تبدیل کند به همین دلیل علاوه بر قسمت اول که کاتالیز گر ها بودند قسمت دومی است که در ان امونیاک وارد میکنند تا دوالاینده را به نیتروژن و اب تبدیل کند.
NO(g) + NO2(g) + 2NH3(g) → 2N2(g) +3H2O(g)
شکل6
گیاهان با جوی سرشار از گاز نیتروژن احاطه شده اند اما نمیتوانند این عنصر ضروری برای رشد خود را بهطور مستقیم از هوا جذب کنند. از اینرو باید نیتروژن را به شکل ترکیبهای نیتروژن دار از جمله آمونیاک و اوره به خاک افزود.
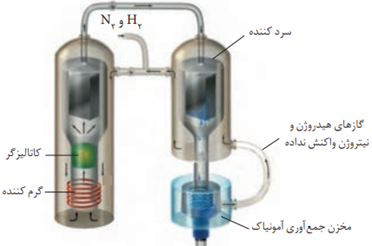
فرایند هابر:
200atm 450C° Fe(s) N2(g)+3H2(g) →NH3(g)
(این واکنش یک واکنش دوطرفه است)
شکل7
اصل لوشاتیه:این اصل بر این قرار است که اگر شما یک واکنش دوطرفه داشته باشید هر تغییری که در واکنش انجام دهید تعادل در جهتی جابه جا میشود که تا حدامکان اثر آن جبران شود. مثال:اگر شما غلظت مولار یک ماده شرکت کننده را زیاد کنید واکنش در جهت رفت انجام میشود تا زمانی که ثابت تعادل به مقدار قبلی خود برگردد(حجم ودما ثابت)(تغییر مولار).
اگر در یک واکنش حداقل یکی از مواد شرکت کننده یا تولید شده به حالت گاز موجود باشد میتوان از حجم برای افزایش یا کاهش غلظت استفاده نمود اگر حجم کاهش یابد در یک واکنش تعادل به سمتی جابه جا می شود که مجموع ضرایب گازها در ان سمت واکنش کمتر است (دلیل در نظرنگرفتن جامدات ومایعات تراکم ناپذیر بودنشان است.)

شکل8
N2(g) + 3H2(g) → 2NH3(g)
برای مثال در واکنش بالا اگر حجم کاهش پیدا کند یا فشار افزایش پیدا کند واکنش در جهت رفت پیشرفت میکند زیرا مجموع ضرایب درسمت راست کمتر از سمت چپ است (2<4).
(دما ثابت)(افزایش حجم=کاهش فشار)(کاهش حجم=افزایش فشار)(ثابت تعادل تغییر نمیکند)
نکته مهم:ثابت تعادل فقط وفقط با دما تغییر میکند.
اگرمجموع ضریب مولهای گازی دو طرف واکنش برابر باشد تعادل ثابت مانده غلظت افزایش یافته ولی شمار مول های دوطرف ثابت میماند.
نکته:ثابت تعادل باتوجه به میزان تغییر دما وگرماده یا گرماگیر بودن واکنش تغییرمیکند(واکنش گرماده باشد با افزایش دما ثابت تعادل کاهش می یابد. واکنش گرما گیرباشد با افزایش دما ثابت تعادل افزایش میابد.)
دلیل مهم بودن فرایند هابر:مشکل اول این واکنش این بود که گرماده است و با افزایش دما درصد مولی گاز امونیاک کاهش می یافت و مشکل کاهش دما این بود که باعث پایین امدن سرعت واکنش و طولانی شدن رسیدن به تعادل بود بخاطر همین موضوع پیدا کردن دما وفشاروکاتالیزگر مناسب زمان بر وسخت بود .
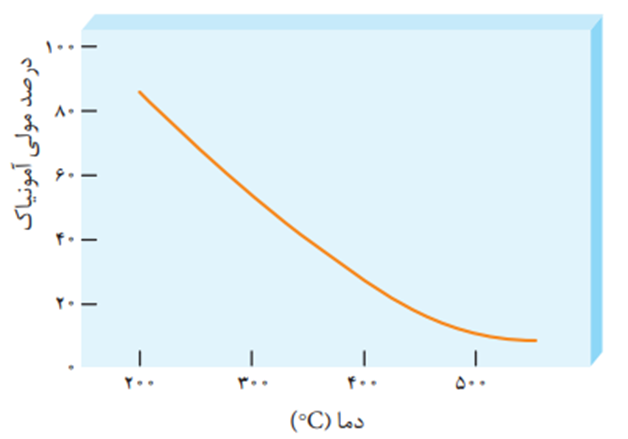
نمودار تاثیر دما در فرایند هابر
شرایطی که در آن، تنها 28 درصد مولی مخلوط را آمونیاک تشکیل میدهد. در پایان برای جداسازی آمونیاک از مخلوط واکنش، از تفاوت آشکار در نقطه جوش آمونیاک با دو گاز دیگر استفاده کرد.(نقطه جوش امونیاک و نیتروژن وهیدروژن به ترتیب برابر است با
-33و-196و-253)
پلی اتیلن ترفاتالات
پلی اتیلن ترفاتالات از واکنش دو ماده ترفتالیک اسید با اتیلن گلیکول به دست می اید که این دو ماده از تقطیر نفت بدست نمی ایند برای تهیه این دوماده باید از دو ماده پارازایلن و اتن استفاده نمود که از نفت خام بدست می ایند.
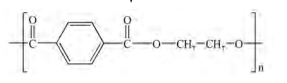
مونومر سازنده پلی اتیلن ترفتالات
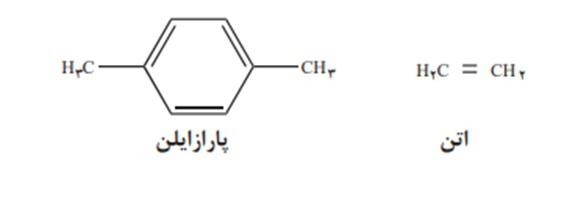
پارازایلن در واکنش با محلول غلیظ پتاسیم پرمنگنات(اکسنده قوی) ترفتالیک اسید میدهد با بازدهی خوب.


ترفتالیک اسید
اتن نیز در واکنش با محلول رقیق و ابی پتاسیم پرمنگنات(اکسنده) اتیلن گلیکول میدهد.
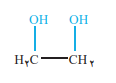
اتیلن گلیکول
یکی از راههای بازیافت پلاستیک ها این است که آنها را پس از شست وشو و تمیز کردن، ذوب کرده و دوباره از آنها برای تولید وسایل و ابزار دیگر استفاده میکنند.
نکته: برای تبدیل پلی اتیلن ترفتالات به مونومر های سازنده ان نیازمند متانول هستیم.
متانول: مایعی بیرنگ، بسیار سمی و سادهترین عضو خانواده الکلها است که میتوان آن را از چوب تهیه کرد.
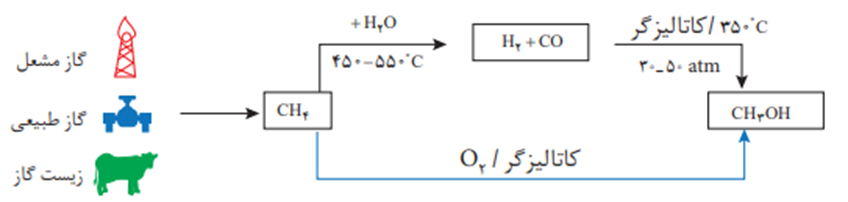
روش اول تولید متانول:
CH4(g) + H2O(g) → CO(g) + 3 H2(g)
CO(g)+2H2(g)→CH3OH (l)
روش دوم:
2CH4(g)+O2(g)→CH3OH(g(
روش دوم به تکونولوژی بالاتری نیازمند است.