سلام دوستان عزیز
بالاخره به آزمون های جمع بندی رسیدیم. ما هم برای شما در دوران جمع بندی مطالبی را از فصل های مختلف شیمی از هر سه پایه در سایت قرار می دهیم. پس با دقت آن را مطالعه کرده و در صورت ابهام یا سوال در قسمت کامنت ها از ما بپرسید.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل اول در کنکور سال های اخیر
کلویید ها
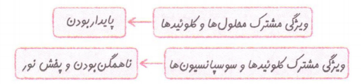
اغلب موادی که در زندگی روزانه با آنها سر و کار داریم، جزء مخلوطها هستند. در شیمی دهم با مخلوط های همگن (محلولها) آشنا شدیم. همان طور که میدانید محلولها (مانند محلول مس (∏) سولفات در آب)، پایدارند و نور را عبور می دهند. حالا می خواهیم با دو دسته دیگر از مخلوط ها (کلوئیدها و سوسپانسیون ها) آشنا شویم. کلوئیدها و سوسپانسیو نها جزء مخلوطهای ناهمگن هستند. ذره های سازنده این مخلوط ها، درشت تر از محلول ها است، به همین دلیل برخلاف محلولها نور را پخش می کنند. شکل روبه رو مقایسه رفتار نور در یک محلول و کلوئید را نشان میدهد. همان طور که می بینید کلوئید برخلاف محلول، مسیر عبور نور از میان کلوئیدها قابل دیدن است. ذره های سازنده کلوئیدها همانند محلول ها با گذشت زمان ته نشین نمی شوند؛ بنابراین می توان گفت کلوئیدها پایدار هستند. موادی مانند انواع رنگ ها و چسب ها، سرامیک ها، شیر، ژله و سس مایونز کلوئید هستند. اما سوسپانسیون ها (مانند شربت معده) ناپایدارند و با گذشت زمان، ذره های سازنده آنها ته نشین می شوند.


پاک کننده های غیر صابونی:
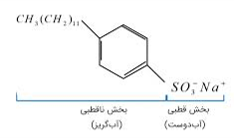
با افزایش تقاضاهای جهانی برای صابون و کاهش عرضه ی این فرآورده، شیمی دان ها با استفاده از موادی مانند بنزن و دیگر مواد اولیه ی صنایع پتروشیمیایی، موفق شدند پاک کننده های غیر صابونی را تولید کنند.

پاک کننده های خوردنده
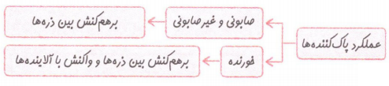
نوعی از پاک کننده های خورنده که به شکل پودر عرضه می شود، شامل مخلوط سدیم هیدروکسید و پودر آلومینیم است. معادله ی نوشتاری واکنش این مخلوط با آب به صورت زیر است:

اسید و بازهای آرنیوس:
اسید آرنیوس: ماده ای است که در آب حل می شود و یون هیدروزن H+ یا پروتون پدید می آورد.
باز آرنیوس: ماده ای است که در آب حل می شود و یون هیدروکسیدOH- پدید می آورد.
هر چه غلظت یون هیدرونیوم H+ در محلولی بیشتر باشد، آن محلول اسیدی تر و هر چه غلظت یون هیدرکسید OH- در محلولی بیشتر باشد، آن محلول بازی تر است. هم چنین اگر در یک سامانه غلظت یون هیدرونیوم و هیدروکسید با هم برابر باشد، آن سامانه حالت خنثی دارد.
یونش: به فرآیندی که در آن یک ترکیب مولکولی در آب به یون های مثبت و منفی تبدیل می شود، یونش می گویند.

اسیدهای قوی:

اسیدهای ضعیف:

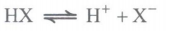
تعادل:
اگه یادتون باشه ! گفتیم که در محلول اسیدهای ضعیف، یون های آبپوشیده به طور همزمان با مولکول های اسید یونیده نشده حضور دارند؛ به طوری که در شرایط معین، غلظت همه گونه های موجود در محلول، ثابت است. حضور همزمان یون ها و مولکول های یونیده نشده با غلظت ثابت در محلول نشان میدهد که محلول اسیدهای ضعیف در آب یک سامانه تعادلی است. حالا ببینیم تعادل یعنی چی؟! در شیمی دهم خواندیم که به واکنش هایی که می توانند در هر دو جهت رفت (تبدیل واکنش دهنده ها به فراورده ها) و برگشت (تبدیل فراورده ها به واکنش دهنده ها) انجام شوند، واکنش های برگشت پذیر می گویند. اگر این واکنش ها در شرایط مناسبی انجام شوند، سرانجام لحظه ای فرا می رسد که سرعت واکنش رفت با سرعت واکنش برگشت برابر می شود. در این لحظه، غلظت واکنش دهنده ها و فراورده ها ثابت می ماند؛ به طوری که همان مقدار از واکنش دهنده ها که در واحد زمان طی واکنش رفت مصرف می شوند، در اثر واکنش برگشت، دوباره تولید می شوند. به همین ترتیب همان مقدار از فراورده ها که در یک واحد زمان طی واکنش رفت تولید می شوند، در اثر واکنش برگشت مصرف می شوند. در این حالت می گوییم واکنش به تعادل رسیده است. برای واکنش های تعادلی از نماد ⇋ استفاده می شود.
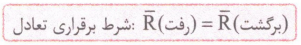
واکنش برگشت ناپذیر: به واکنشی گفته میشود که واکنش دهنده ها به فرآورده ها تبدیل شوند. اما فرآورده ها نمیتوانند به واکنش دهنده ها تبدیل شوند. مانند سوختن مواد آلی یا واکنش فلز های قلیایی با آب.
نکته: همه ی واکنش های گرماده که شمار مول های گازی فرآورده بیشتر از شمار مول های واکنش دهنده باشد، برگشت ناپذیر هستند.
نکته: در یک واکنش شیمایی اگرq (گرما) در طرفی باشد که تعداد مول های گازی کمتر است، واکنش برگشت پذیر می باشد.
نکته: واکنش های رفت و برگشت در سامانه های تعادلی به طور پیوسته و با سرعت برابر انجام می شوند و به همین دلیل مقدار مواد در واکنش ثابت می ماند.
نکته: تا قبل از برقراری تعادل در یک واکنش برگشت پذیر، خواصی مانند غلظت، جرم، حجم، فشار و رنگ تغییر می کند، اما زمانی که تعادل برقرار شد، غلظت و سایر خواص ثابت می مانند و تغییر نمی کنند. در هنگام تعادل سرعت تولید هر ماده با سرعت مصرف آن ماده برابر است.
نکته: مقدار تغییر غلظت هر ماده بستگی به ضریب استوکیومتری آن ماده در معادله ی موازنه شده ی واکنش دارد. در ضمن غلظت واکنش دهنده ها در واکنش های تعادلی به صفر نمی رسد.



سخت – آزمون کانون قلم چی 1400


متوسط – آزمون کانون قلم چی 1400


ساده – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400
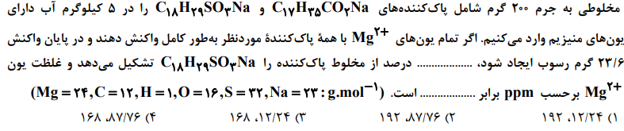

متوسط – آزمون کانون قلم چی 1400

دوستان عزیز برای دسترسی به نسخه کامل خلاصه نکات و همچنین تعداد تست های بیشتر به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید.
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




