سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات فصل دوم شیمی دهم تا صفحه 69 مطابق با بودجه بندی آزمون 21 بهمن که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
ترکیب اکسیژن با فلزها و نافلزها
اغلب فلزها در طبیعت به شکل ترکیب (عمدتا به شکل اکسید) وجود دارند. به طور مثال فلزهای آلومینیم و آهن به ترتیب به صورت ترکیب های بوکسیت (Al2O3 به همراه ناخالصی) و هماتیت (Fe2O3 به همراه ناخالصی) در طبیعت یافت می شوند.
به واکنش آرام مواد با اکسیژن که با تولید انرژی همراه است، اکسایش می گویند. به طور مثال زنگ زدن آهن نمونه ای از واکنش های اکسایش است که در آن آهن با اکسیژن در هوای مرطوب واکنش میدهد.
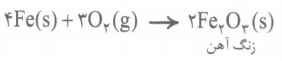
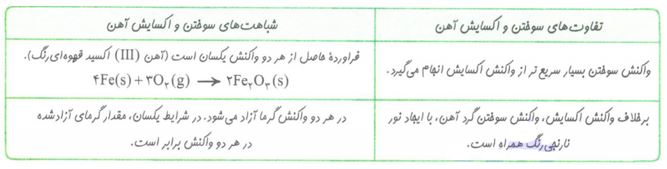
زنگ آهن، متخلخل است و باعث می شود بخار آب و اکسیژن به لایه های زیرین فلز آهن هم نفوذ کند و فرایند اکسایش آهن تا تبدیل همه فلز به زنگار، ادامه پیدا کند. این ماده استحکام لازم را ندارد و در اثر ضربه خرد می شود و فرو می ریزد. به ترد و خرد شدن و فروریختن فلزها بر اثر اکسایش، خوردگی گفته میشود. و اگه دقت کرده باشین! واکنش فلز آهن با اکسیژن می تواند از نوع سوختن یا از نوع اکسایش باشد! بیایید به نیم نگاهی به تفاوت ها و شباهت های این دو واکنش بندازیم!
هر چه واکنش پذیری یک فلز بیشتر باشد، سرعت آن با اسید بیشتر شده، در نتیجه در یک بازهء زمانی معین، حباب های گازی بیشتری تولید می شود.
سیم های انتقال برق با ولتاژ بالا (فشار قوی)، علاوع بر داشتن رسانایی الکتریکی زیاد، باید ضخیم باشند و به عبارتی استحکام بالایی داشته باشند.
در برخی از کشورها رشتهء درونی این سیم ها را از فولاد می سازند؛ زیرا فولاد که آلیاژی از آهن است، ارزان تر است و استحکام بالایی دارد. اما همهء این سیم ها را نمی توان از فولاد ساخت؛ چون چگالی فولاد زیاد است و اگر همهء سیم از فولاد ساخته شود، به دلیل جرم زیاد، سیم بین دو دکل برق به سمت پایین انحنا پیدا می کند و به مرور زمان باعث فرسایش سیم و خطوط برق می شود؛ به همین دلیل روکش این سیم ها را از آلومینیم می سازند؛ به چند دلیل:
1- آلومینیم فلزی سبک است.
2- آلومینیم اکسید ساختاری متراکم و پایدار دارد و از خوردگی رشته های درونی سیم جلوگیری می کند.
3- رسانایی الکتریکی آلومینیم از آهن بیشتر است.
چون آلومینیم خیلی انعطاف پذیر و فلزی گران قیمت است همهء سیم را از آن نمی سازند.
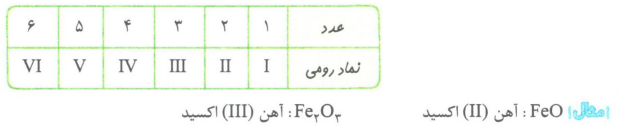
برخی از فلزها مانند آهن در واکنش با اکسیژن، دو نوع اکسید تولید می کنند. در واقع آهن با اکسیژن ترکیب و ابتدا به FeO تبدیل می شود. سپس این ترکیب با اکسیژن واکنش داده و به Fe2O3 اکسایش می یابد. برای نام گذاری ترکیب های فلزهایی مانند آهن که بیش از یک نوع کاتیون با بار متفاوت دارند، باید بار کاتیون با اعداد رومی داخل پرانتز داده شود.
برای نام گذاری اکسیدهای نافلزی و به طور کلی ترکیب های مولکولی شامل دو نافلز به صورت زیر عمل می کنیم:
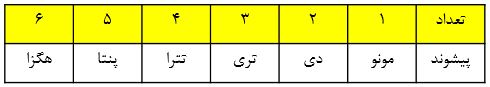
«پسوند یونانی (در صورت لزوم) + نام نافلز سمت چپ + پیوشند یونانی + نام نافلز سمت راست(یا ریشهء آن) + ید»
N2O4: دی نیتروژن تترا اکسید Cl2O: دی کلرو مونوکسید
اگر در فرمول مولکولی ترکیب مورد نظر، فقط یک اتم از نافلز سمت چپ وجود داشته باشد، از به کار بردن پیشوند «مونو» پیش از نام عنصر چشم پوشی می شود.
NO2: نیتروژن در اکسید PCl3: فسفر تری کلرید
رسم ساختار لوویس
برای رسم انواع ساختار لوویس از الگوریتم داده شده استفاده میکنیم مراحل باید به ترتیب طی شوند.
1- مجموع تعداد الکترون های ظرفیت اتم های موجود در مولکول را محاسبه کنید.
2- تعداد الکترون های لازم برای هشتایی شدن را به صورت زیر محاسبه کنید.

4- اتمی که در فرمول شیمیایی ترکیب مورد نظر در سمت چپ نوشته می شود را (به جز اتم H) به عنوان اتم مرکزی انتخاب کنید.
5- اتم های اطراف را با استفاده از تعداد پیوند های به دست آمده در مرحله ی سوم به اتم مرکزی متصل کنید.
نکته: اتم های هیدروژن و هالوژن ها با پیوند یگانه به اتم مرکزی وصل می شوند.
نکته: اتم های اکسیژن و گوگرد می توانند در صورت نیاز با پیوند دوگانه به اتم مرکزی متصل شوند.
نکته: اتم نیتروژن می تواند با پیوند سه گانه به اتم مرکزی متصل شود.
6- در اطراف (به جز اتم H) به تعداد مورد نیاز برای هشتایی شدن، الکترون ناپیوندی قرار دهید.
برای بدست آوردن بار یون ها، در صورتی که تعداد ساختار لوویس آن داده شده باشد، می توانید از رابطه مقابل استفاده کنید:
(پیوندی و ناپیوندی) مجموع الکترون های موجود در یون - مجموع الکترون های ظرفیت اتم ها = بار یون(q)

رفتار فلزها
رفتار همه فلزها در برابر اکسیژن یکسان نیست. به طور مثال با این که فلز آلومینیم نیز با اکسیژن هوا واکنش می دهد و به آلومینیم اکسید تبدیل می شود، اما در برابر خوردگی مقاوم است و برخلاف آهن، لایه های درونی فلز اکسایش نمی یابد؛ به همین دلیل بیشتر وقتا! در ساختمان سازی به جای در و پنجره های آهنی از در و پنجره های آلومینیمی استفاده می شود. حالا دلیل این اتفاق اینه که هر چند آلومینیم واکنش پذیری بیشتری از آهن دارد و خیلی سریع اکسید می شود، اما آلومینیم اکسید تولیدشده ساختاری متراکم و پایدار دارد که محکم به سطح فلز می چسبد و از نفوذ اکسیژن به لایه های زیرین آلومینیم جلوگیری می کند. این طوری میشه که آلومینیم خورده نمی شود. Al > Zn > Fe :واکنش پذیری
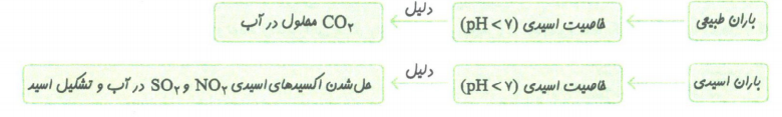
باران اسیدی
باران طبیعی به دلیل وجود کربن دی اکسید محلول در آن، اندکی اسیدی و دارای pH کمتر از ۷ است، اما برخی آلاینده های هوا مانندNO, SO که اکسید اسیدی هستند، می توانند با آب و اکسیژن موجود در هوا واکنش دهند و در نهایت به اسیدهای قوی نیتریک اسید HNO_3 و سولفوریک اسید H_2 SO_4 تبدیل شوند. این اسیدها به طور قابل توجهی! بر مقدار اسیدی بودن آب باران اضافه می کنند. به این باران، باران اسیدی می گویند. و باران اسیدی آثار جبران ناپذیری بر جنگل ها، باغهای میوه و زندگی آبزیان دارد. هم چنین آثار زیانبار باران اسیدی بر روی پوست، دستگاه تنفس و چشم ها به سرعت قابل تشخیص است و گاهی خاصیت اسیدی آن باعث خشک شدن و ترک خوردگی پوست بدن می شود.
تست 2:

تست 3:


نمایش واکنش های شیمیایی
تغییر شیمیایی تغییری است که با تغییر در ساختار و ماهیت مواد همراه است و ماده یا مواد جدیدی تولید می کند این نوع تغییر با تغییر رنگ، مزه، بو و آزاد سازی گاز، رسوب و گاهی ایجاد نور و صدا همراه است. به عنوان مثال گرما دادن به شکر سبب تغییر رنگ آن می شود. سوختن، فساد مواد غذایی و... نمونه هایی دیگر از تغییرات شیمیایی هستند.
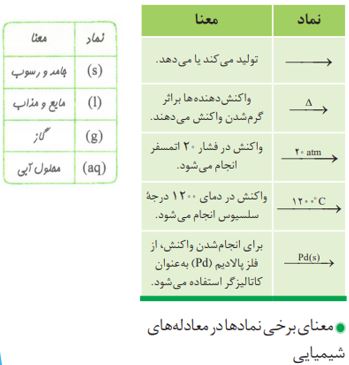
موازنه کردن معادله ی واکنش های شیمیایی
بر طبق قانون پایستگی جرم، جرم واکنش دهنده ها با جرم فرآورده ها برابر است. یا به عبارت دیگر جرم کل مواد در طول واکنش ثابت است.
در واکنش های شیمیایی نه اتمی به وجود می آید و نه اتمی از بین می رود، بلکه پس از انجام واکنش، اتم های موجود در واکنش دهنده ها به یون های دیگری به هم متصل می شوند و فرآورده ها را به وجود می آورند.
همانطور که مشاهده می شود معادله زیر موازنه نیست. برای نمونه تعداد تمامی اتم های کربن در سمت راست برابر 1 ولی در سمت چپ برابر 7 است. در حقیقت تعداد اتم های فرآورده ها و واکنش دهنده ها برابر نیست.
C7H16(l)+O2(g)→CO2(g)+H2O(g)
برای موازنه کردن یک معادله شیمیایی می توانید مطابق با گام های زیر پیش بروید.
1- در ابتدا پیچیده ترین ماده را شناسایی کنید.
2- برای ماده انتخاب شده، عنصری را انتخاب کنید که تنها در واکنش دهنده ها یا فرآورده ها ظاهر شده باشد. عنصر انتخاب شده را در طرفین معادله موازنه کنید.
3- در مرحله بعد بارهای یون ها را در طرفین موازنه کنید.
4- اتم های باقی مانده را موازنه کنید. معمولا این فرآیند با ساده ترین ترکیب به پایان می رسد. اگر حتی یکی از ضرایب بدست آمده نیز به صورت کسری هستند می توانید طرفین معادله را در مخرج کسر ضرب کنید؛ با انجام این کار تمامی ضرایب صحیح شده و درک بهتری را از کل معادله بدست خواهید آورد.
5- در گام اخر باید تعداد کل اتم ها را در دو طرف معادله موازنه کنید. در حقیقت تعداد اتم های تمامی عناصر باید در دو سمت معادله برابر باشد.
C7H16(l)+11O2(g)→7CO2(g)+8H2O(g)
تست 4:

تست 5:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی




