سلام
در این مطلب میخواهیم با هم به جمع بندی نکات فصل سوم شیمی دهم (مطابق با آزمون 31 اردیبهشت) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
محلول، مخلوطی همگن از دو یا چند ماده است که حالت فیزیکی و شیمیایی محلول در سرتاسر آن یکسان و یکنواخت است.
حلال، جزئی از محلول است که حل شونده را در خود حل میکند و شمار مول های آن بیشتر است.
خواص محلول به خواص حلال، حل شونده و مقدار هر یک از آن ها بستگی دارد.
غلظت یک محلول برابر با مقدار حل شونده در مقدار معینی از حلال یا محلول تعریف می شود. برای بیان غلظت محلول های بسیار رقیق از کمیتی به نام قسمت در میلیون (ppm) استفاده می شود.
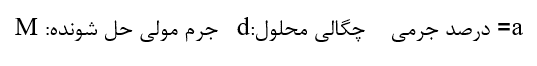
با افزودن مقداری حل شونده به یک محلول درحجم ثابت، غلظت محلول افزایش می یابد.
با افزودن مقداری حلال به محلولیبا غلظت معین، غلظت محلول کاهش می یابد.
انحلال پذیری
بیشترینمقدار یک ماده بر حسب گرم که در 100 گرم حلال در دمای معین حل می شود، انحلال پذیری آن ماده نامیده می شود.
مواد بر اساس انحلال پذیری در آب در دمای معین به سه دسته تقسیم می شوند:
1- مواد محلول: موادی هستند که انحلال پذیری آن ها در دمای معین بیش از 1 گرم در 100 گرم آب باشد. مانند شکر، سدیم نیترات، سدیم کلرید.
2- مواد نامحلول: موادی هستندکه انحلال پذیری آن ها در دمای معین کم تر از 0/01 گرم در 100 گرم آب باشد. مانند کلسیم فسفات، نقره کلرید و باریم سولفات.
3-مواد کم محلول: موادی هستند که انحلال پذیری آن ها در دمای معین بین 0/01 تا 1 گرم در 100 گرم آب باشد. مانند کلسیم سولفات.
محلولسیر نشده: محلولی است که در یک دمای معین، میتواند مقدار بیشتری از ماده ی حل شونده را در خود حل کند، یعنی مقدار ماده ی حل شونده کمتر از مقدار انحلال پذیری آن ماده در همان دما است.
محلولسیر شده: محلولی است که در دمای معین، نمیتواند مقدار بیشتری از ماده ی حل شونده را در خود حل کند.
محلولفرا سیر شده: محلولی است که در دمای معین، مقدار حل شونده ی موجود در آن بیشتر از مقدار انحلال پذیری آن ماده در همان دما باشد. این محلول ناپایدار است و بر اثر ضربه، تغییر ناگهانی دما و یا اضافه کردن مقداری حل شونده، مقدار اضافی حل شونده در محلول به سرعت رسوب می کند.
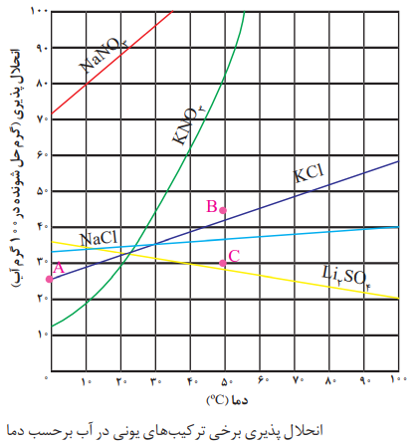
نکته: انحلال پذیری نمک ها به نوع آن ها و دما بستگی دارد، ولی تاثیر دما بر مقدار انحلال پذیری آن ها یکسان نیست.
نموداری که اثر دما بر انحلال پذیری یک ماده را نشان می دهد، نمودار انحلال پذیری _ دما گویند.
نکته: دراین نمودار، نقاط روی منحنی نشان دهنده ی محلول سیر شده، نقاط زیر منحنی نشان دهنده ی محلول سیر نشده و نقاط بالای منحنی نشان دهنده محلول فراسیر شده است.
نکته: به طور کلی هر چه شیب نمودار یک ماده بیشتر باشد، تاثیر دما بر انحلال پذیری آن بیش تر است.
نکته: اگر در مسائلی جرم رسوب تولید شده ضمن کاهش دما (در نمودار های صعودی) و یا افزایش دما (در نمودار های نزولی) خواسته شود، می توان از کسرهای تناسبی زیر استفاده کرد.

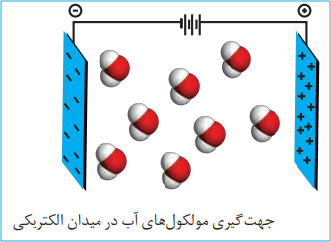
مولکول های قطبی: نحوۀ جهت گیری مولکول های آب در میدان الکتریکی نشان میدهد که اتم اکسیژن، سرِ منفی و اتم های هیدروژن، سرِ مثبت مولکول را تشکیل می دهند. شیمیدانها به مولکول هایی مانند آب که در میدان الکتریکی جهت گیری می کنند، مولکولهای دوقطبی یا قطبی می گویند.
مولکول های ناقطبی: مولکولهای سازندۀ ترکیبهایی مانند گاز اکسیژن ، کربن دی اکسید و متان در میدان الکتریکی جهت گیری نمی کنند چنین مولکول هایی، ناقطبی نامیده می شوند.
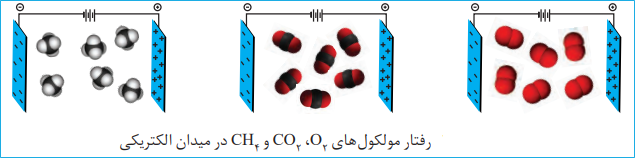
انواع نیروهای بین مولکولی: میان مولکول های سازنده ی یک ماده بر هم کنش هایی وجود دارد که موجب می شود یک ترکیب بتواند به یکی از 3 حالت گاز، مایع یا جامد در بیاید. به این نیرو ها و برهم کنش ها نیروی بین مولکولی گفته می شود.
نیروهای بین مولکولی عبارت اند از:
1- نیرو های واندروالسی
2- پیوند هیدروژنی
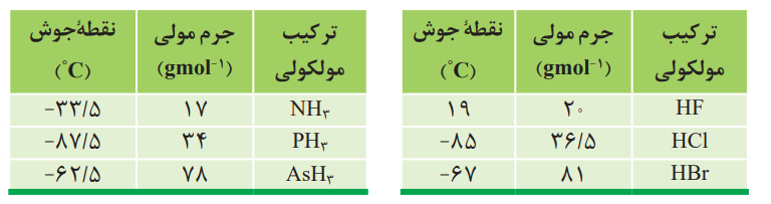
نیروهای واندروالسی به دو عامل بستگی دارد: 1- قطبیت مولکول ها 2- جرم مولی
نکته: به طور کلی هر چه نیرو های بین مولکولی در ترکیبی قوی تر باشد، ترکیب مورد نظر آسان تر از گاز به مایع تبدیل می شود.
پیوند هیدروژنی: یکی از انواع نیرو های بین مولکولی است که بین مولکول های دارای اتم هیدروژن متصل به یکی از اتم های F, O, N ایجاد می شود.
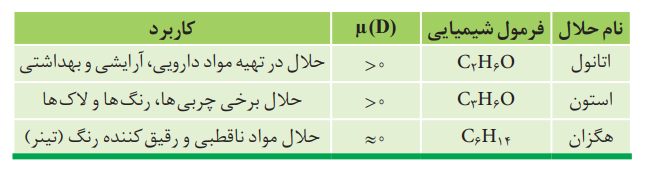
حلال های مهم و انحلال پذیری در آن ها:
نکته: آب و اتانول در هر نسبتی در آب حل می شوند و نمی توان محلول سیر شده از آن ها تهیه کرد.
هگزان مانند اغلب هیدروکربن ها، دارای گشتاور دو قطبی ناچیز و در حدود صفر است. بنابراین ناقطبی بوده و در آب حل نمی شود. بنابراین مخلوط آّب و هگزان، مخلوطی ناهمگن است.
مواد الکترولیت و غیر الکترولیت به موادی که بر اثر انحلال در آب، به طور کامل و یا به مقدار کم تفکیک شده و ایجاد یون می کنند، مواد الکترولیت گفته می شود و به محلول حاصل، محلول الکترولیت می گویند. مانند محلول نمک ها یا محلول برخی از ترکیبات قطبی در آب.
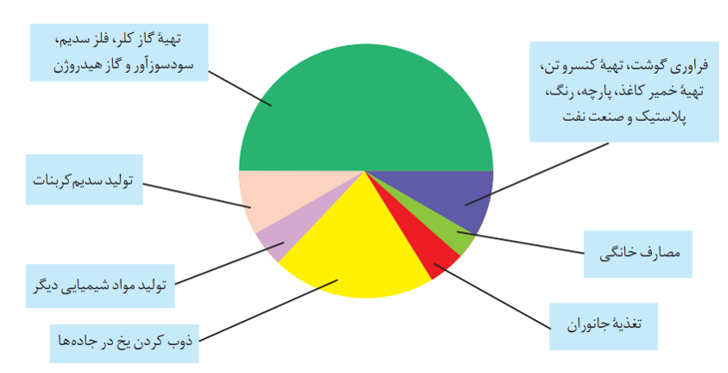
انحلال پذیری گاز ها:
انحلال پذیری گازها در آب به 3 عامل زیر وابسته است:
1- نوع گاز: گازهایی که دارای مولکول های قطبی هستند در آب که حلال قطبی است، به میزان کمی حل می شوند. ولی گازهایی که دارای مولکول های قطبی هستند در آب به میزان بیشتری حل می شوند.
2- دما: انحلال پذیری گاز ها با دما رابطه ی عکس دارد. یعنی با افزایش دما، انحلال پذیری گازها کاهش می یابد و نمودار انحلال پذیری آن ها به صورت نزولی است.
3- فشار: برطبق قانون هنری انحلال پذیری گازها با فشار رابطه مستقیم دارد. یعنی اگر در دمای ثابت، فشار افزایش داده شود، انحلال پذیری گازها در آب بیش تر می شود.
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


