دانش آموزان عزیز سلام💕
در این مطلب نکات مرتبط با بخش انتهایی فصل چهارم شیمی دوازدهم را به همراه نمونه سوال نهایی و تست کنکور بررسی می کنیم.
درسنامه شامل :
خلاصه مطالب و نکات
5 تست کنکور سال های اخیر
سوالات نهایی مربوطه

سوالات نهایی:
متانول در بازیافت شیمیایی PET به کار می رود. مودار زیر دو روش تولید متانول از متان را نشان می دهد.
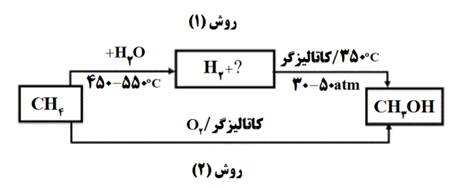
آ) جای علامت (؟) فرمول شیمیایی فراورده تولید شده را بنویسید.
ب)چرا تبدیل متان به متانول دشوار است؟
پ)در تهیه متانول از متان، روش (2) به نسبت روش (1) چه مزیتی دارد؟

با توجه به واکنش های زیر پاسخ دهید.
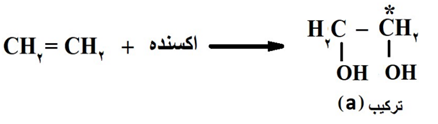
آ) نام ترکیب (a) را بنویسید.
ب)اکسنده مناسب این واکنش چیست؟
پ)عدد اکسایش کربن ستاره دار را به دست آورید.

سامانه های تعادلی زیر را در نظر بگیرید.
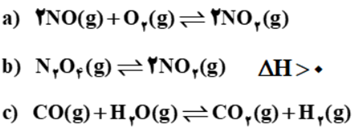
آ) برای سامانه (a) عبارت ثابت تعادل را بنویسید.
ب)در کدام واکنش کاهش حجم در دمای ثابت سبب افزایش مقدار فراورده ها می شود؟ چرا؟
پ)با افزایش دما، غلظت گاز N2O4 در واکنش (b) چه تغییری می کند؟ دلیل بنویسید.
یکی از مونومر های سازنده PET است. (پارازایلن/ترفتالیک اسید)
ترفتالیک اسید
●واکنش (a/b) از دیدگاه اتمی به صرفه است.

b
درسنامه:
محدودیت منابع و روند رو به افزایش جمعیت سبب شده تا تأمین غذا به یکی دیگر از چالش های زندگی تبدیل شود. بهترین راه حل برای این مسئله، افزایش بهره وری در تولید فراورده های کشاورزی است.
گیاهان نمی توانند نیتروژن مورد نیاز برای رشد خود را به طور مستقیم از هوا جذب کنند. از این رو باید نیتروژن را به شکل ترکیب های نیتروژن دار از جمله آمونیاک و اوره به خاک افزود.
در برخی کشورها برای افزایش بازده فراورده های کشاورزی، آمونیاک مایع را به عنوان کود شیمیایی به طور مستقیم به خاک تزریق می کنند.
گیاهان برای رشد افزون بر کربن دی اکسید و آب به عنصرهایی مانند N، P، k، Sو ... نیاز دارند.
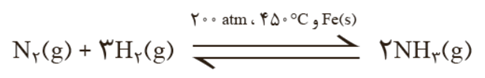
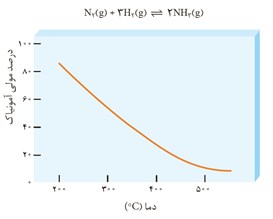
در دمای اتاق، واکنش میان گازهای نیتروژن و هیدروژن حتی در حضور کاتالیزگر یا جرقه پیش نمی رود. از سوی دیگر این واکنش، برگشت پذیر است و می تواند در شرایط مناسب به تعادل برسد. تعادلی که در دمای معین، مخلوطی از گازهای واکنش دهنده و فراورده با غلظت ثابت است. فریتس هابر این واکنش را بارها و بارها در شرایط گوناگون انجام داد و سرانجام موفق شد شرایط بهینه واکنش را بیابد.
اگر تغییری سبب به هم خوردن یک سامانه تعادلی شود، تعادل در جهتی جابه جا می شود که تا حد امکان اثر آن تغییر را جبران کند. این توصیف، بیانی از اصل لوشاتلیه است.
هنگامی که بر یک تعادل تغییری وارد می کنیم معمولا مقداری از آثار تغییر وارده باقی می ماند.
واکنش تعادلی با افزایش غلظت یکی از مواد شرکت کننده در دمای ثابت، در جهتی پیش می رود که تا حد امکان مقداری از آن را مصرف کند و به تعادل جدید برسد اما در این جا به جایی k ثابت می ماند و بالعکس.
کاهش حجم یک سامانه محتوی تعادل گازی یا افزایش فشار بر این سامانه در دمای ثابت سبب می شود که تعادل در جهت شمار مول های گازی کمتر جابه جا شود زیرا هرچه شمار مول های گاز موجود در یک سامانه کمتر باشد، شمار برخورد مولکول ها به دیواره ها کمتر و در نتیجه فشار گاز کمتر خواهد شد بدیهی است که افزایش فشار بر یک واکنش تعادلی با شمار مول های گازی برابر در دو سوی معادله واکنش، تأثیری بر جابه جایی تعادل نخواهد داشت.
تنها عاملی که افزون بر جابه جا کردن تعادل، توانایی تغییر K را نیز دارد، دماست. در واقع هنگامی که دمای یک سامانه محتوی تعادل گازی تغییر می کند، پس از رسیدن به تعادل جدید افزون بر تغییر غلظت مواد شرکت کننده، K نیز تغییر خواهد کرد. اثر تغییر دما بر تعادل های گوناگون، یکسان نیست و به گرماده یا گرماگیر بودن آنها بستگی دارد. هنگامی که دمای یک سامانه تعادلی افزایش می یابد، واکنش در جهت مصرف گرما پیش می رود، اگر این واکنش گرماگیر باشد مقدار واکنش دهنده ها در سامانه کاهش می یابد. و بالعکس.
تغییر مقدار مواد جامد و مایع خالص باعث جا به جایی تعادل نمی شود زیرا با تغییر مقدار مواد جامد یا مایع خالص غلظت آنها همچنان ثابت می ماند.
در سامانه های گازی با کم کردن حجم ظرف غلظت کلیه مواد در تعادل جدید افزایش می یابد و بالعکس. با کم کردن حجم هم سرعت واکنش رفت هم برگشت زیاد می شود.
در تعادل هایی که هیچ گونه ماده گازی شکل نداریم تغییرات فشار بر جا به جایی تعادل و سرعت واکنش بی اثر است.
در تعادل هایی که معادله ثابت تعادل در آنها فقط شامل غلظت یک ماده است، غلظت ماده مورد نظر فقط تابع دما است، یعنی در این حالت افزودن مواد، تغییر حجم یا تغییر فشار سامانه نمی تواند غلظت ماده مورد نظر را تغییر دهد.
چنان چه یک تعادل را به صورت معکوس بنویسیم مقدار ثابت تعادل معکوس می شود.
چنان چه یک تعادل را در عددی ضرب کنیم مقدار ثابت تعادل به توان آن عدد می رسد.
چنان چه یک واکنش از جمع دو واکنش به دست آید مقدار ثابت تعادل آن برابر حاصل ضرب مقدار k در تعادل های اولیه را در هم ضرب می کنیم.
بزرگ بودن مقدار k نشان دهنده این است که از نظر ترمودینامیکی میل زیادی به انجام در جهت رفت دارد اما سرعت واکنش قابل پیش بینی نیست چون ممکن است عوامل سینیتیکی مثل Ea فراهم نشده باشد.
برای برقراری تعادل باید دست کم یا همه واکنش دهنده ها و یا همه فراورده ها در ظرف موجود باشد.
افزودن کاتالیزگر بعد تعادل باعث می شود سرعت واکنش رفت و برگشت به یک اندازه و به یک نسبت افزایش پیدا کند.
فریتس هابر می دانست که با افزایش دما و تأمین انرژی فعال سازی، سرعت واکنش افزایش خواهد یافت. هابر دریافت که افزایش دما نمی تواند برای تولید آمونیاک بیشتر ثمربخش باشد. او با استفاده از کاتالیزگر توانست واکنش را در دماهای پایین تر با سرعت مناسب انجام دهد، هر چند که هنوز هم درصد مولی آمونیاک در مخلوط مطلوب نبود. او برای رفع این مشکل، از افزایش فشار بر سامانه بهره برد. در این شرایط بعد تعادل 28درصد مولی مخلوط را آمونیاک تشکیل می دهد. در پایان برای جداسازی آمونیاک از مخلوط واکنش، از تفاوت آشکار در نقطه جوش آمونیاک با دو گاز دیگر استفاده کرد.

فرایند هابر نمونۀ تاریخی جالبی از تأثیر پیچیدۀ شیمی بر زندگی ماست. هرچند تولید آمونیاک باعث طولانی ترشدن جنگ جهانی اول گردید، اما به دنبال آن شرایط تولید کودهای شیمیایی و افزایش بازدهی فراورده های کشاورزی فراهم شد.
نفت خام، گاز طبیعی، زغال سنگ و معادن مس، آهن، طلا، مرمر و فیروزه از جمله منابع شیمیایی ارزشمندی هستند که به طور یکسان در جهان توزیع نشده اند. به همین دلیل برخی کشورها، صادر کننده این منابع و برخی دیگر وارد کننده آنها هستند.
بسیاری از کشورها منابع طبیعی خود را کم و بیش بدون فراوری و به همان صورتی که از طبیعت به دست می آید، به فروش می رسانند. فرایندی که به خام فروشی منابع معروف است. روش دیگر این است که به کمک فناوری های شیمیایی مواد خام و اولیه را به فراورده های دیگر تبدیل کرد تا بتوان به قیمت با لاتری به فروش رساند.
هر چه درصد خلوص ماده شیمیایی بیشتر باشد، قیمت آن نیز بیشتر خواهد بود. به همین دلیل فناوری های جداسازی و خالص سازی مواد یکی از فناوری های پیشرفته، گران، پرکاربرد و در عین حال کارآفرین ودرآمدزا به شمار می رود.

در مجتمع مس سرچشمه کرمان کلیه عملیات از استخراج تا تهیه فلز مس انجام می شود.
قیمت تقریبی:
اتیلن گلیکول > متانول > روغن موتور > اتانول > پلی اتن > بنزین
به کارگیری فناوری و تبدیل مواد خام به مواد فراوری شده، سبب رشد و بهره وری اقتصاد یک کشور می شود. فناوری را می توان به کار بردن دانش برای حل یک مسئله در صنعت یا زندگی روزانه برای رسیدن به هدفی خاص دانست. فناوری همواره با ساخت یا استفاده از یک وسیله همراه است.
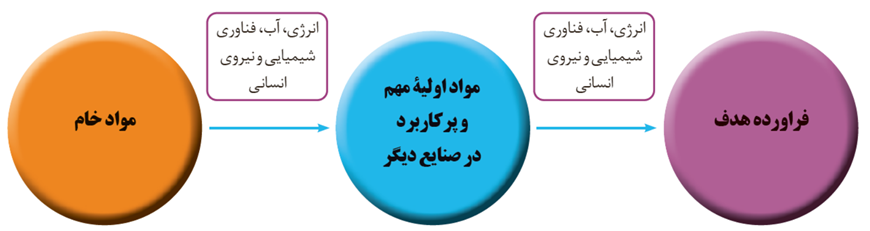
مواد خام، موادی مانند نمک، سنگ معدن، نفت خام و هوا هستند که فراوری نشده اند و با استفاده از آنها می توان مواد شیمیایی جدید تولید کرد.
سنتز یک فرایند شیمیایی هدفمند است که در آن با استفاده از مواد ساده تر، مواد شیمیایی دیگر را تولید می کنند.
اغلب مواد آلی شامل گروه های عاملی گوناگون هستند. گروه هایی که خواص و رفتار مواد آلی را تعیین می کنند. تولید یک ماده آلی جدید می تواند با تغییر ساختار یا ایجاد یک یا چند گروه عاملی همراه باشد.
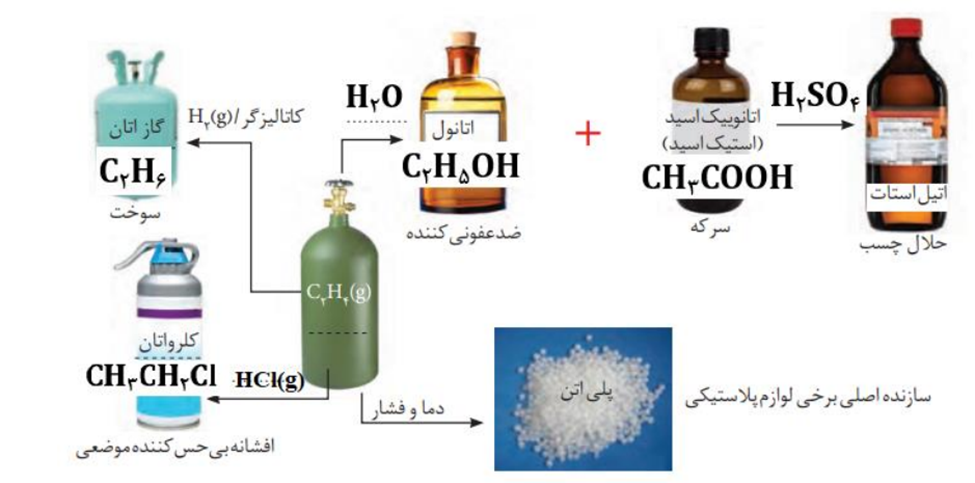
در واکنش تبدیل اتن به کلرو اتان اتن هم اکسنده و هم کاهنده است، کاتالیزگر این واکنش گاز هیدروژن کلرید است نه هیدروکلریک اسید.
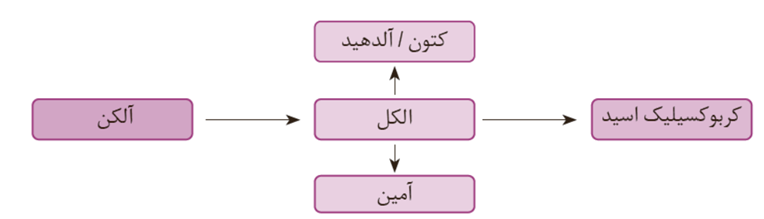
آلکن در واکنش با آب هم نقش اکسنده هم کاهنده را بازی می کند و به الکل تبدیل می شود.
در تبدیل الکل ها به آمین ها عدد اکسایش اتم های کربن تغییری نمی کند و این تبدیل از نوع اکسایش کاهش نیست.
بدیهی است هر چه نوع و شمار گروه های عاملی در مولکول هدف بیشتر باشد، ساخت آن دشوارتر بوده و به دانش پیشرفته تر و فناوری کارآمدتری نیاز دارد.
بازده واکنش، هزینه مواد و انرژی مصرف شده برای تولید ماده هدف به نوع واکنش و فناوری به کاررفته بستگی دارد. از این رو شیمی دان ها در پی یافتن مواد مناسب، ارزان و دوستدار محیط زیست، همچنین واکنش های شیمیایی آسان و پربازده هستند تا هزینه تمام شده تولید یا سنتز را کاهش دهند.
تولیدات صنایع شیمیایی یا به طور مستقیم در زندگی روزانه ما مصرف می شوند یا برای تولید مواد و کالاهای جدید در صنایع دیگر مورد استفاده قرار می گیرند. به همین دلیل صنایع شیمیایی بر صنایع دیگر تأثیر می گذارد.
بطری آب از پلیمری به نام پلی اتیلن ترفتالات (PET) ساخته می شود. برای ساخت این بطری، نخست پلیمر آن را تهیه می کنند. سپس این پلیمر را به همراه برخی افزودنی ها در قالب های ویژه ای می ریزند تا به شکل بطری مورد نظر درآید.
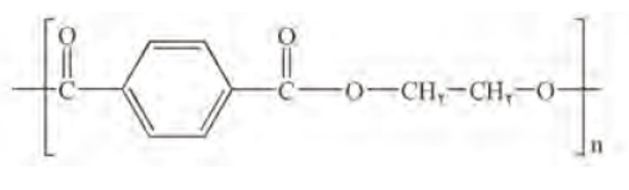
پلیمر سازنده بطری آب که از نوع پلی استر است.
واکنش مونومرهای سازنده این پلیمر یعنی اتیلن گلیکول(الکل دو عاملی) با ترفتالیک اسید (اسید دوعاملی) در شرایط مناسب می توان پلی اتیلن ترفتالات را سنتز کرد.
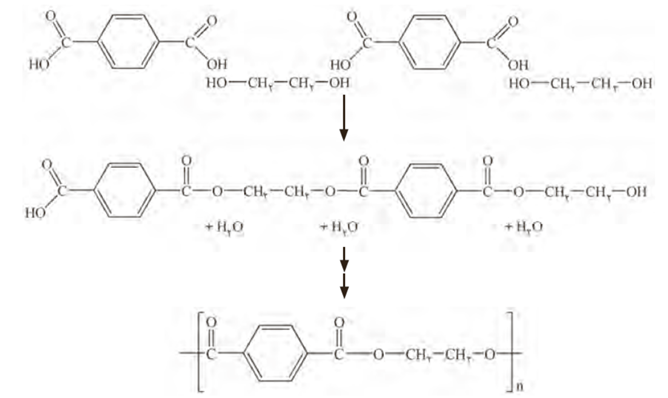
اتیلن گلیکول و ترفتالیک اسید در نفت خام وجود ندارند.
اتن، بنزن، پارازایلن در نفت خام وجود دارند.
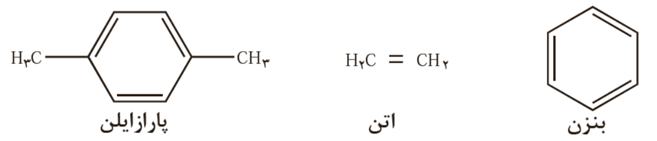
پارازایلن:
پتاسیم پرمنگنات اکسنده ای است که محلول غلیظ آن در شرایط مناسب پارازایلن را با بازده نسبتاً خوب به ترفتالیک اسید تبدیل می کند.
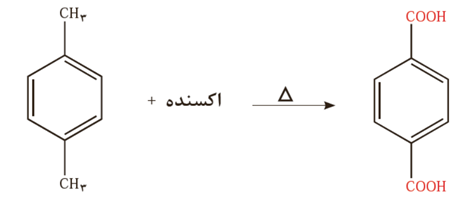
در این واکنش یون پرمنگنات به منگنز (IV) اکسید تبدیل می شود.
هر مولکول پارازایلن 12 درجه اکسایش یافته است و 4 یون پرمنگنات به اندازه 3 درجه کاهش یافته است.
انرژی فعالسازی این واکنش زیاد است و برای تامین آن به دمای بالا نیاز داریم.
یون پرمنگنات گونه ای اکسنده است و سبب اکسایش گونه های دیگر می شود. با وجود غلظت بالای آن، باز هم شرایط تبدیل پارازایلن به ترفتالیک اسید تأمین نمی شود. مگر آنکه دمای مخلوط واکنش افزایش یابد. با افزایش دما اگرچه شرایط انجام واکنش تأمین شده است اما بازده همچنان مطلوب نیست. همه اینها نشان می دهد که اکسایش پارازایلن به ترفتالیک اسید دشوار است. شیمی دان ها با پژوهش های فراوان دریافتند که استفاده از اکسیژن هوا و کاتالیزگرهای مناسب می تواند راهگشا باشد.
اتیلن گلیکول:
گاز اتن در اثر واکنش با محلول آبی و رقیق پتاسیم پرمنگنات در شرایط مناسب به اتیلن گلیکول تبدیل می شود.

در مجموع عدد اکسایش اتم 2 تا افزایش یافته است.
می توان با انجام واکنش اتیلن گلیکول با ترفتالیک اسید پلی اتیلن ترفتالات را سنتز کرد.
پلاستیک ها به دلیل ویژگی هایی مانند چگالی کم، نفوذناپذیری نسبت به هوا و آب، ارزان بودن و مقاومت در برابر خوردگی، کاربردهای وسیعی در زندگی پیدا کرده اند؛ به طوری که امروزه سالانه حدود 400میلیون تن از این مواد در جهان تولید می شود و این روند روبه افزایش است.
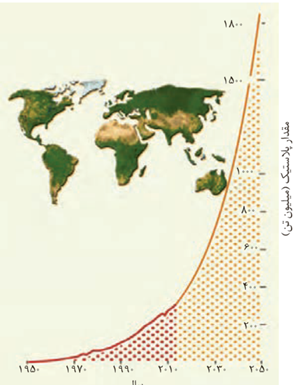
استفاده بی رویه و بیش از حد این مواد در صنایع گوناگون به همراه زیست تخریب ناپذیری آنها سبب شده که درجای جای کره زمین یافت شوند. از این رو بازیافت آنها اجتناب ناپذیر است.
یکی از مواد پلاستیکی قابل بازیافت، پلی اتیلن ترفتالات است. برای این منظور، باید آنها را جداگانه جمع آوری و سپس با انجام فرایندهای فیزیکی و شیمیایی به مواد قابل استفاده تبدیل کرد.

سطح فناوری هر کشور یا گروه صنعتی است که تعیین می کند کدام راه را باید انتخاب کرد، زیرا برگرداندن پسماندها به مونومرهای سازنده کاری بس دشوار است. از آنجا که سا لانه حجم انبوهی از پسماندهای این پلیمر تولید می شود، بازیافت شیمیایی آن بسیار ضروری و ارزشمند است.
صنعت بازیافت به یکی از کلیدی ترین صنایع در قرن آینده تبدیل خواهد شد. بدیهی است هر کشوری که از دانش و فناوری پیشرفته تری برخوردار باشد سهم قابل توجهی از این بازار جهانی را به خود اختصاص خواهد داد.
PETدر شرایط مناسب با متانول واکنش می دهد و به مواد مفیدی تبدیل می شود؛ موادی که می توان آنها را برای تولید پلیمرها به کار برد. بررسی ها نشان می دهد که سا لانه به مقدار زیادی متانول در مقیاس صنعتی نیاز است.
متانول مایعی بی رنگ، بسیار سمی و ساده ترین عضو خانواده الکل ها است که می توان آن را از چوب تهیه کرد. از آنجا که این الکل کاربردهای زیادی در صنایع گوناگون دارد باید آن را در مقیاس صنعتی تولید کرد. در صنعت گاز کربن مونوکسید را با گاز هیدروژن در شرایط مناسب و در حضور کاتالیزگر واکنش می دهند. معادله شیمیایی این واکنش به صورت زیر است:

مواد واکنش دهنده برای این واکنش در دسترس نیستند از این رو نخست باید آنها را تولید و سپس به متانول تبدیل کرد.
برای تهیه گازهای کربن مونوکسید و هیدروژن می توان از واکنش گاز متان با بخار آب در حضور کاتالیزگر بهره برد.

در این واکنش آب حالت گازی دارد.
گاز متان سازنده اصلی گاز طبیعی است که در میدان های نفتی به فراوانی یافت می شود.در این میدان ها برای افزایش ایمنی، بخش قابل توجهی از آن را می سوزانند. گاز متان واکنش پذیری بسیار کمی دارد و تبدیل آن به متانول فرایندی دشوار است که انجام آن به دانش و فناوری پیشرفته نیازمند است. به دلیل اهمیت متانول در صنایع گوناگون از یک سو و ارزان بودن گاز متان از سوی دیگر ، پژوهش های شیمیایی زیادی در حال انجام است. تا بتوان روشی برای تبدیل گاز متان به متانول پیدا کرد.
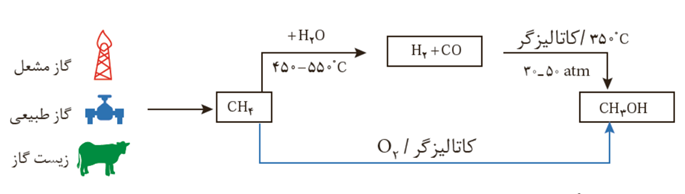
هر دو مرحله نیاز به کاتالیزگر دارند.
از مجموع دو واکنش بالا واکنش پایینی به دست نمی آید.
از هر سه مول هیدروژن که در مرحله اول تولید شده تنها دو مول آن در مرحله دوم مصرف می شود و یک مول در پایان واکنش باقی می ماند.
در مسیر بالایی واکنش دوم نیاز به دمای کمتری نسبت به واکنش اول دارد.
مقدار زیادی گاز متان از دستگاه گوارش جانورانی مثل گاو خارج می شود.
مزیت تولید مستقیم متانول از متان این است که نیاز به دمای بالا ندارد بنابراین با مصرف سوخت کمتر همراه بوده و گاز گلخانه ای کمتری تولید می کند و اثرات زیست محیطی آن کمتر است.
تهیه ماده A به دو روش:
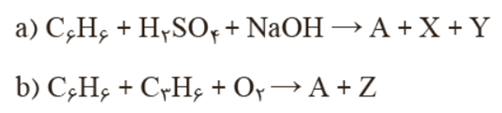
در این واکنش ها X و Y پسماند هستند، اما Z یک حلال صنعتی است.
یک واکنش شیمیایی هنگامی از دیدگاه اتمی به صرفه تر است که شمار بیشتری از اتم های واکنش دهنده ها به فراورده های سودمند تبدیل شود.
با توجه به اینکه در معادله روش اول تنها بخشی از اتم های مواد واکنش دهنده تبدیل به فراورده های سودمند شده اند اما در روش دوم علاوه بر فراورده های اصلی یک حلال صنعتی و مفید به دست آمده است، پس در روش دوم کلیه اتم های مواد واکنش دهنده به فراورده سودمند تبدیل شده و بر اساس اصول شیمی سبز از دیدگاه اتمی صرفه اقتصادی بیشتری دارد.
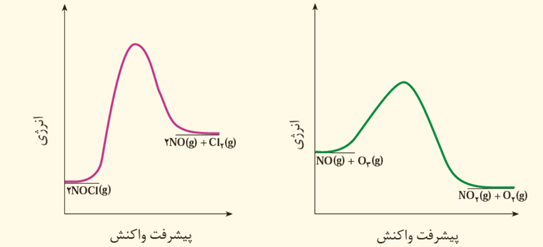
سرعت واکنش NOCl کمتر است چون انرژی فعالسازی آن بیشتر است و تامین انرژی مورد نیاز برای واکنش آن دشوار تر است.
تحلیل ویدیویی سوالات کنکور✨💖


