توجه:
شما با مطالعه این درسنامه می توانید به سوالات 641-660 و 721-740 از کتاب نوروز و سوالات 276،278،443،598،613،616،773،1081،1082،1235،1237 از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
سلام به همه کانونی های عزیز
در این مطلب قصد داریم نکات فصل یک شیمی دوازدهم مبحث الکترولیت ها و اسید ها را به همراه سوالات نهایی و کنکور در اختیار شما قرار دهیم تا آمادگی لازم را کسب کنید 💕
 | رویا خواجوی رتبه 8 منطقه سه ، کنکور تجربی 1403 دانشجوی دندانپزشکی شهید بهشتی |
درسنامه شامل :
خلاصه مطالب و نکات
5 تست کنکور سال های اخیر
سوالات نهایی مربوطه
در ابتدا برای اینکه به اهمیت این مبحث پی ببریم به بررسی چند سوال امتحان نهایی می پردازیم .
• شیر سالم با افزایش غلظت یون هیدرونیوم، ترش شده به طوری كه دیگر قابل نوشیدن نیست . در واقع در شیر ترش شده اسید های ضعیفی وجود دارد که باعث می شود دیگر قابل نوشیدن نباشد .
• در فرایند تولید مواد گوناگون اغلب تعیین و كنترل غلظت یون هیدرونیوم نقش مهمی دارد. یكی از روش هایی كه برای تعیین غلظت یون هیدرونیوم میتوان به كار برد، سنجش رسانایی الكتریكی محلول های آبی است .
• موادی که رسانایی آنها به وسیله الکترون ها انجام می شود، به آن ها رسانای الکترونی می گویند .
•موادی که رسانایی آن ها به وسیله یون ها انجام می شود و به آن رسانای یونی میگویند . این رسانایی هنگامی انجام میشود که یون ها بتوانند از نقطه ای به نقطه دیگر جابه جا شوند، زیرا در این شرایط بارهای الکتریکی نیز جا به جا خواهند شد .
• در محلول سدیم کلرید جا به جایی یون ها نشان دهندۀ جا به جایی بارهای الکتریکی و نتیجه، رسانایی الکتریکی محلول سدیم کلرید است .
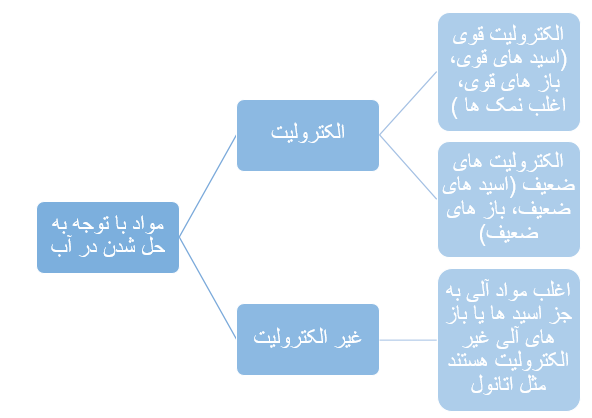
• به موادی مانند NaCl(s) الکترولیت و به موادی مانند NaCl(aq) محلول الکرولیت میگویند.
• به موادی مانند اتانول و شکرکه انحلال آنها در آب به شکل مولکولی است، غیرالکترولیت و به محلول آن ها، محلول غیرالکترولیت می گویند .
• اگر محلول الکترولیت های گوناگون در چنین مداری قرار گیرند، روشنایی یکسانی در لامپ ایجاد نمی کنند.
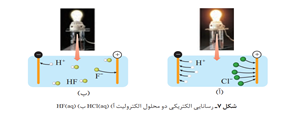
• در الکترولیت های قوی هر چه تعداد یون های حاصل از انحلال بیشتر باشد رسانایی الکتریکی بیشتر است .
• به فرایندی که در آن یک ترکیب مولکولی در آب به یون های مثبت و منفی تبدیل میشود، یونش می گویند.
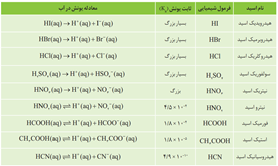
• به اسیدی که هر مولکول آن در آب تنها می تواند یک یون هیدرونیوم تولید کند، اسید تك پروتون دار می گویند.
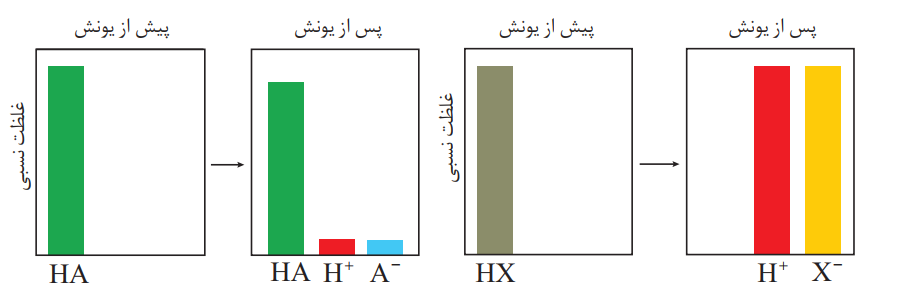
اسید قوی(هیدروکلریک اسید) اسید ضعیف(هیدروفلوئوریک اسید)
• برای بیان میزان یونش اسیدها، از کمیتی به نام درجه یونش ( α) استفاده می شود .

• در رابطه درجه یونش به جای شمار مولکول ها، میتوان شمار مول ها یا غلظت مولی گونه ها را قرار داد . در منابع علمی معتبر گاهی به جای درجه یونش از درصد یونش (α×100)استفاده می کنند .
•(در اسید های تک پروتون دار) α = غلظت اسید÷غلظت یون هیدروژن
• درجه یونش یک اسید ضعیف با دما رابطه مستقیم و با غلظت محلول رابطه عکس دارد .
• می توان اسیدها را بر مبنای میزان یونشی که در آب دارند در دو دسته قوی و ضعیف جای داد. اسیدهایی قوی هستند که میتوان یونش آنها را در آب کامل در نظر گرفت (α ≅1) اسیدهای ضعیف در آب به میزان جزئی یونیده می شوند و شمار یون ها در محلول آن ها کم است (α < 1) . اسیدهای قوی را میتوان محلولی شامل یون های آب پوشیده دانست، به طوری که در آنها ً تقریبا مولکول های یونیده نشده یافت نمی شود. این در حالی است که در محلول اسیدهای ضعیف افزون بر اندک یون های آب پوشیده، مولکول های اسید نیز یافت می شوند.
• در شرایط یکسان دما و غلظت هر چه درجه یونش بزرگتر قدرت اسید بیشتر است .
• کربوکسیلیک اسیدها از جمله اسیدهای ضعیف هستند که تنها هیدروژن گروه کربوکسیل آن ها می تواند به صورت یون هیدرونیوم وارد محلول شود .
• اسیدهای موجود در سیب، انگور، ریواس و مرکبات مانند پرتقال و لیمو و نیز انواع سرکه از جمله اسیدهای خوراکی و ضعیف هستند .
• اسید هایی که در زندگی روزمره با آنها سر و کار داریم برخی قوی و اغلب آنها ضعیف هستند.
• در یك واکنش برگشت پذیر که همزمان واکنش های رفت و برگشت به طور پیوسته انجام می شوند، سرانجام مقدار واکنش دهنده ها و فراورده ها ثابت می ماند و این هنگامی رخ می دهد که سرعت واکنش رفت با برگشت برابر شود . به چنین سامانه هایی، سامانه تعادلی می گویند. سامانه تعادلی باید بسته باشد و با محیط پیرامون مبادله جرم نداشته باشد .
• خواص سامانه تعادلی ( رنگ ، دما ، غلظت مواد و ... ) با گذشت زمان بدون تغییر باقی می ماند .و غلظت واکنش دهنده ها می تواند کمتر بیشتر یا مساوی غلظت فراورده ها باشد .
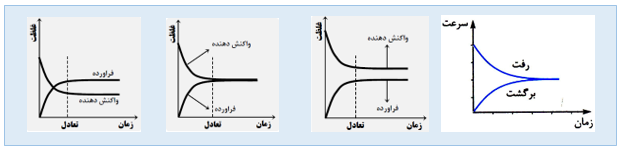
• معادله یونش اسید ها و باز های ضعیف در آب به صورت تعادلی است .
• Kبرای یك واکنش تعادلی در دمای معین، مقداری ثابت است. هر چه مقدار آن بیشتر باشد تمایل واکنش برای انجام در جهت رفت بیشتر است .
• در یک تعادل معین تنها عاملی که می تواند مقدار عددی ثابت تعادل را تغییر دهد دماست
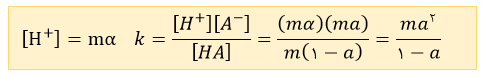
• اگر مقدار درجه یونش یک اسید کمتر از 0.05 باشد یا ثابت یونش آن کمتر از باشد ثابت تعادل به تقریب از رابطه مقابل به دست می آید .
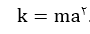 • ثابت یونش، بیانی از میزان پیشرفت فرایند یونش تا رسیدن به تعادل است، در واقع در دمای معین هر چه ثابت یونش اسیدی بزرگتر باشد، آن اسید قوی تر است.
• ثابت یونش، بیانی از میزان پیشرفت فرایند یونش تا رسیدن به تعادل است، در واقع در دمای معین هر چه ثابت یونش اسیدی بزرگتر باشد، آن اسید قوی تر است.
 • واکنش هیدروکلریک اسید با فلز منیزیم : HCl + Mg MgCl2 + H2
• واکنش هیدروکلریک اسید با فلز منیزیم : HCl + Mg MgCl2 + H2
• در شرایط یکسان اسیدی که دارای ثابت یونش بزرگتری است با شدت بیشتری با فلز هایی مثل منیزیم واکنش می دهد .
• باران اسیدی حاوی نیتریک اسید و سولفوریک اسید است در حالی که باران معمولی حاوی کربنیک اسید است .
• رنگی که کاغذ پی اچ درون یک محلول به خود می گیرد، نشان دهنده pHتقریبی آن محلول است .

• شیر ترش شده، خاصیت اسیدی داشته و pH < 7 دارد .
• PH برای محلول های آبی در دمای اتاق با اعدادی در گستره 0تا 14بیان می شود .
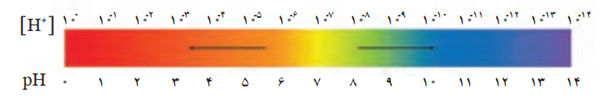
• آب و همه محلول های آبی، محتوی یون های هیدرونیوم و هیدروکسید هستند.
• سامانه هایی، خنثی هستند که :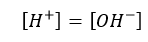
• آزمایش های دقیق نشان می دهند که آب خالص رسانایی الکتریکی ناچیزی دارد . این ویژگی بیانگر وجود مقدار بسیار کمی از یون های هیدرونیوم و هیدروکسید است . در یک نمونه از آب خالص شمار بسیار ناچیزی از مولکول های H2Oبه یون های هیدرونیوم و هیدروکسید یونیده می شوند .
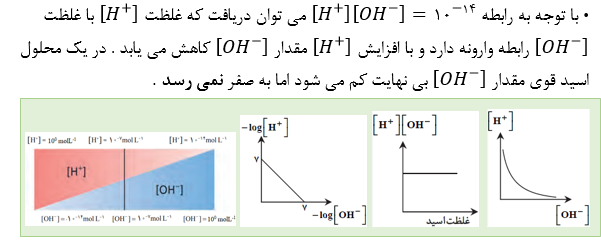
• خاصیت اسیدی یک محلول با قدرت اسیدی آن محلول تفاوت دارد خاصیت اسیدی محلول تابع غلظت اسید مورد نظر است و هر چه غلظت اسید بیشتر باشد غلظت یون هیدرونیوم بیشتر و پی اچ کمتر می شود ولی قدرت اسیدی تابع غلظت اسید نیست و تنها از روی ثابت یونش تعیین می شود . خاصیت اسیدی یک محلول به غلظت و قدرت اسید بستگی دارد . پی اچ معیاری برای میزان خاصیت اسیدی یا بازی محلول هاست نه قدرت آن ها .
• میزان اسیدی بودن آب گازدار از بازی بودن آمونیاک کمتر است .
• محاسبه غلظت هیدرونیوم بعد مخلولط کردن دو یا چند محلول:
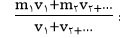
در محلول اسید قوی اگر حجم محلول را n برابر کنیم PH به اندازه logn افزایش می یابد و اگر حجم محلول باز قوی را n برابر کنیم PH به اندازه logn کاهش می یابد.
• اگر محلول یک اسید ضعیف را n برابر کنیم PH به اندازه نصف logn افزایش می یابد .
• با افزایش دما آب بیشتر یونش یافته و غلظت یون هیدروکسید و هیدرونیوم افزایش می یابد و PH محلول خنثی کمتر از 7 می شود .
• واکنش های اسید و باز در جهت تولید اسید و باز ضعیف تر پیش می روند .
سوالات نهایی و کنکور مطابق با مطلب را در فایل پی دی اف مطالعه کنید .


