سلام. من فرزین رستمی هستم، رتبه 871 کنکور تجربی97 و رتبه 262 کنکور ریاضی92. در این مطلب نکات و مفاهیم مبحث همانندسازی، گفتار دوم فصل 1 زیست دوازدهم، را با هم مرور خواهیم کرد. فصلی که توانایی ترکیب با همه فصل های هر سه کتاب زیست شناسی متوسطه دوم را دارد.
پروتئین ها
علاوه بر دنا و رنا كه در سلول ذخيره و حمل اطلاعات را بر عهده دارند مولکولهای دیگری نیز هستند که کمک می کنند فرایندهای مختلف سلولی به انجام برسد. از جمله این ملکول ها پروتئینها هستند که نقش بسیار مهمی در فرایندهای یاخته ای دارند. بسیاری از فرایندهای یاخته ای را پروتئینها انجام می دهند. بنابراین از بین رفتن عملكرد آنها اختلال گستردهای را در کار یاخته ها و بافتها ایجاد میكند.
ساختار پروتئینها
نکته 1: پروتئینها بسپارهای خطی از آمینواسیدها هستند. نوع، ترتیب و تعداد آمینواسیدها در پروتئین، ساختار و عمل آنها را مشخص میکند. آمینواسیدها همان طور که از نامشان بر میآید یک گروه آمین (NH2-) و یک گروه اسیدی کربوکسیل (COOH-) دارند. همان طور که در شکل می بینید گروه آمین و کربوکسیل به همراه یک هیدروژن و گروه R همگی به یک کربن مرکزی متصل اند و چهار ظرفیت آن را پر می کنند.
نکته ۲: گروه R در آمینواسیدهای مختلف متفاوت است و ویژگیهای منحصر به فرد هر آمینواسید به گروه R آن بستگی دارد. هر آمینواسید می تواند در شکل دهی پروتئين مؤثر باشد و تأثیر آن به ماهیت شیمیایی گروه R بستگی دارد.
نکته ۳: هنگامی که آمینواسیدی در محیط آبی (یاخته) قرار می گیرد، گروه آمین بار مثبت (+) و گروه کربوکسیل بار منفی (-) به خود می گیرند. این دو گروه در آمینواسیدهای مختلف می توانند به همدیگر نزدیک شوند و با حضور آنزیم غیرپروتئینی بنام rRNA، واکنش سنتز آبدهی را انجام دهند (ساخته شدن رشته پلی پپتیدی). در این نوع واکنش با خروج یک مولکول آب، یک آمینواسید با آمینواسید دیگر پیوند اشتراکی ایجاد می کند. این پیوند اشتراکی بین آمینواسیدها را پیوند پپتیدی می گویند. هنگام تشکیل هر پیوند پپتیدی دو عدد پیوند کووالانسی شکسته می شود.

نکته 4: پیوند پپتیدی نوعی پیوند کووالانسی (پیوند اشتراکی) است که توسط آنزيم غير پروتئینی به نام rRNA طی واكنش سنتز آبدهی ایجاد می شود. تشکیل پیوند پپتیدی انرژی خواه است. پیوند پپتیدی بین نیتروژن عامل آمين و كربن عامل كربوكسيل است (نه كربن مركزی). توجه کنید که هیچوقت بين گروههای R دو آمینواسید پیوند پپتیدی تشکیل نمی شود. زنجيره پلی پپتید با n عدد آمینواسید 1-n عدد پیوند پپتیدی دارد.
نکته 5: وقتی تعدادی آمینواسید با پیوند پپتیدی به هم وصل شوند، زنجیرههایی از آمینواسیدها به نام پلی پپتید تشکیل می شود. هر زنجیره پلی پپتید در یک انتهای خود عامل آمین و در انتهای دیگر عامل کربوکسیل دارد. دقت کنید موقع پروتئین سازی یک آمینواسید فقط می تواند به انتهای کربوکسیل زنجیره پلی پپتیدی متصل شود یعنی آمینواسید جدید فقط به یکی از دو انتهای زنجیره پلی پپتیدی متصل میشود؛ نمی تواند به انتهای آمین زنجیره متصل شود.
نکته 6: در هنگام پروتئینسازی موقع اتصال یک آمینواسید به زنجیره پلی پپتیدی، هیدروژن عامل آمین آمینواسید و OH عامل کروبوکسیل زنجیره پلی پپتیدی با حضور آنزیم، واکنش سنتز آبدهی را انجام میدهند (هیدروژن و OH با هم تشکیل مولکول آب میدهند) و بین نیتروژن آمینواسید و کربن زنجیره پلی پپتیدی، پیوند پپتیدی برقرار می شود. اگر بگویند هیدروژن عامل آمین زنجیره و OH عامل کروبوکسیل آمینواسید واکنش سنتز آبدهی را انجام می دهند، غلط است.
نکته 7: پروتئینها از یك یا چند زنجیره بلند و بدون شاخه از پلی پپتیدها ساخته شده اند. هر نوع پروتئین، ترتیب خاصی از آمینواسیدها را دارد که با استفاده از روش های شیمیایی، میتوان آمینواسیدها را جدا و آنها را شناسایی کرد. اگرچه آمینواسیدها در طبیعت انواع گوناگونی دارند اما فقط ۲۰ نوع از آنها در ساختار پروتئین ها به کار می روند.
نکته ۸: شكل فضایی پروتئین، نوع عمل آن را مشخص می کند. یکی از راههای پی بردن به شکل پروتئین استفاده از پرتوهای ایکس است. با استفاده از تصاویر حاصل از آن و روش های دیگر، محققین به ساختار سه بعدی پروتئینها پی می برند که در آن حتی جایگاه هر اتم را می توانند مشخص کنند. اولین پروتئینی که ساختار آن شناسایی شد میوگلوبین بود. این پروتئین از يك رشته پلی پپتید تشکیل شده است.
نکته 9: در نتیجه تجزیهی آمینواسیدها و نوکلئوتیدها، آمونیاک تولید می شود. که بسیار سمی است. در كبد دو عدد مونياك با يك عدد كربن دی اکسید ترکیب می شود و به اوره تبدیل می شود. اوره فراوان ترین ماده دفعی آلی در ادرار است.
نکته 10: ماده دفعی آلی نیتروژن دار دیگر که در ادرار وجود دارد، اسید اوریك است که در نتیجه سوخت و ساز نوکلئیک اسیدها حاصل میشود. اوریک اسید انحلال پذیری زیادی در آب ندارد، بنابراین تمایل آن به رسوب کردن و تشکیل بلور زیاد است. رسوب بلورهای اسید اوریک در کلیه باعث ایجاد سنگ کلیه و در مفاصل باعث بیماری نقرس می شود.
ساختار اول پروتئین - توالی آمینواسیدها
ساختار پروتئین ها در چهار سطح بررسی می شود که هر ساختار مبنای تشکیل ساختار بالاتر است. ، نوع، تعداد، ترتیب و تکرار آمینواسیدها، ساختار اول را تعیین می کند. ساختار اول با ایجاد پیوندهای پپتیدی (کووالانسی) بین آمینواسیدها شکل می گیرد و به صورت خطی است. این پیوند در واقع نوعی پیوند اشتراکی است.
نکته 1: تغيير آمینواسید در هر جایگاه موجب تغییر در ساختار اول پروتئین می شود ولی ممکن است فعالیت آن را تغییر بدهد یا تغيير ندهد.
نکته۲: با در نظر گرفتن ۲۰ نوع آمینواسید و اینکه محدودیتی در توالی آمینواسیدها در ساختار اول پروتئین ها وجود ندارد پروتئین های حاصل می توانند بسیار متنوع باشند. با توجه به اهمیت توالی آمینواسیدها در ساختار اول، همه سطوح دیگر ساختاری در پروتئین ها به ساختار اول بستگی دارند.
نکته ۳: نوع، ترتیب و تعداد آمینواسیدها در پروتئین، ساختار و عمل آنها را مشخص می کند. توالی (ترتیب) آمینواسیدها در ساختار اول هر پروتئین مستقیما توسط کدون های mRNA ولی اساسأ توسط ژن ها تعیین می شود. جهش ژنی می تواند ساختار و عملکرد پروتئین ها را تغییر دهد.
نکته 4: اولین آمینواسید در انتهای آمین (نه کربوکسیل) همه پلی پپتیدهای تازه ساخته شده آمینواسید متیونین است.
ساختار دوم- الگوهایی از پیوندهای هیدروژنی
نکته 1: بين بخشهایی(نه همه بخش ها) از يك زنجيره پلی پپتیدی(نه زنجیره های پلی پپتیدی) می تواند پیوندهای هیدروژنی (نوعی پیوند غيراشتراكي) برقرار شود. پیوندهای هیدروژنی منشأ تشکیل ساختار دوم در پروتئین ها هستند که به چند صورت دیده می شود دو نمونه معروف آنها ساختار مارپیچ و ساختار صفحه ای است. اگر بگویند ساختار دوم فقط به دو صورت مارپیچ و صفحه ای است، جمله ای نادرست است.
نکته 2: در ساختار دوم، بین هیدروژن عامل آمین ( NII) و اکسیژن عامل کربوکسیل (CO) (له اکسیزن عامل هیدروکسیل) برخی آمینواسیدهای غیر مجاور از یک زنجیره (نه زنجیره های پلی پپتیدی پیوند هیدروژنی برقرار می شود. تشگیل پیوند هیدروژنی بین بخش هایی از یک زنجیره است و تشکیل هیدروژنی نیاز به آنزیم ندارد.
ساختار سوم- تاخورده و متصل به هم
ساختار سوم، ساختاری سه بعدی و ساختار نهایی پروتئین هایی است كه فقط يك زنجيره پلی پپتیدی دارند. ساختار سوم، ساختار سه بعدی پروتئین هاست که در آن با تاخوردگی بیشترِ صفحات و مارپیچها رخ می دهد و پروتئینها به شکل های متفاوتی در می آیند. تشكيل این ساختار در اثر برهمكنشهای آبگریز است، به این صورت که گروه های R آمینواسیدهایی که آب گریزند، به یکدیگر نزدیک می شوند تا در معرض آب نباشند. سپس با تشكیل پیوندهای دیگری مانند هیدروژنی، اشتراکی و یونی ساختار سوم پروتئین تثبیت می شود. مجموعه این نیروها قسمتهای مختلف پروتئین را به صورت به هم پیچیده در کنار هم نگه می دارند. بنابراین با وجود این نیروها پروتئینهای دارای ساختار سوم، ثبات نسبی دارند. ایجاد تغییر در پروتئین، حتی تغییر یک آمینواسید هم می تواند ساختار و عملکرد آنها را به شدت تغییر دهد. میوگلوبین نمونه ای از پروتئین با ساختار سوم است.
نکته 1: در ساختار دوم بین هیدروژن عامل آمین (NH) یک آمینواسید و اکسیژن عامل کربوکسیل (CO) آمینواسید غیر مجاور در یک زنجیره، پیوند هیدروژنی برقرار می شود. ولی در ساختار سوم پیوند هیدروژنی بین گروههای R دو آمینواسید غير مجاور است. در ساختار سوم بین گروههای R علاوه بر هیدروژنی پیوند هیدروژنی پیوندهای یونی و اشتراکی برقرار می شود. دقت کنید که در هیچ ساختاری بین گروه های R پیوند پپتیدی برقرار نمی شود.
نکته 3: در ساختار سوم یک بخش از زنجیره پلی پپتیدی می تواند بصورت مارپیچ و بخشی دیگر به صورت صفحه ای باشد.
نکته 4: منشأ تشكیل پیوند پپتیدی در ساختار اول و منشأ پیوند هیدروژنی در ساختار دوم و منشأ ساختارهای آبگریز و پیوندهای یونی در ساختار سوم است.
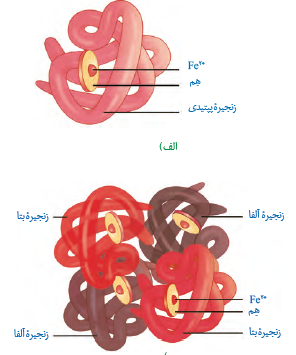
نکته 5: اولین پروتئینی که ساختار آن شناسایی شد میوگلويين بود. این پروتئین از يك رشته (نه رشته ها) پلی پپتید و یک گروه هِم تشکیل شده است. آهن جزء گروه هِم آن است. همانند هموگلوبین اکسیژن به آهن گروه هِم متصل می شود (نه زنجیره پلی پپتیدی). برخلاف هموگلوبین توان اتصال به انواع گازهای (کربن دی اکسید و كربن مونواکسید) را ندارد.
نکته 6: در ماهیچه های بدن مانند دیافراگم، ذوزنقه ای، دلتایی... هم هموگلوبین و هم میوگلوبین یافت میشود. درون تارهای ماهیچه ای میوگلوبین و در مویرگهای ماهیچهای هموگلوبین یافت میشود. دقت کنید که درون تارهای ماهیچه ای هموگلوبین یافت نمی شود. و در مویرگهای ماهیچه ای، میوگلوبین یافت نمی شود.
ساختار چهارم- آرایش زیر واحدها
بعضی از پروتئینها ساختار چهارم دارند، این ساختار هنگامی شکل می گیرد که دو یا چند زنجیره پلی پپتید در کنار یکدیگر پروتئین را تشکیل دهند. هر پروتئینی که ساختار چهارم دارد قطعأ از چند زنجیره پلی پپتیدی تشکیل شده است. در ساختار چهارم هریک از زنجیره ها نقشی کلیدی در شکل گیری پروتئین دارند. نحوه آرایش این زیر واحدها در کنار هم ساختار چهارم پروتئین ها نامیده می شود.
نکته 1: هموگلوبین از چهار گروه غیر پروتئینی به نام هِم و چهار زنجیره پلی پپتیدی (از دو نوع متفاوت) تشکیل شده است. دو زنجیره از نوع آلفا و دو زنجیره از نوع بتا است. هر رشته، به یک گروه غیر پروتئینی به نام هِم متصل است. هر گروه هِم یک اتم آهن دارد، که می تواند بطور برگشت پذیر به یک مولکول اکسیژن متصل شود. کربن مونواکسید می تواند به هموگلوبین متصل شود، محل اتصال این مولکول به هموگلوبین همان محل اتصال اکسیژن است.
نکته 2: دقت کنید که در ساختار هموگلوبین و میوگلوبین آهن به گروه هِم متصل است. (نه به زنجیره پلی پپتید) به همین علت است که اکسیژن و کربن مونوکسید به زنجیره پلی پپتید وصل نمی شوند؛ بلکه به گروه هِم متصل می شوند.
نکته 3: هر زنجیره هموگلوبین ترتیب خاصی از آمینواسیدها را در ساختار اول دارند. در ساختار دوم به شكل مارپیچ در می آیند. ساختار نهایی هر زنجیره آلفا و هر زنجيره بتا ساختار سوم است. در ساختار سوم هریک از زنجیرهها به صورت یک زیر واحد، تا خورده و شکل کروی خاصی پیدا می کند. در نهایت در ساختار چهارم این چهار زیر واحد در کنار هم قرار گرفته و هموگلوبین را شکل می دهند. توجه کنید که در ساختار چهارم بین زیر واحدها پیوند پپتیدی وجود ندارد.
نقش پروتئینها
نکته 1: بسیاری از فرآیندهای یاخته ای را پروتئینها انجام میدهند. پروتئینها متنوع ترین گروه مولکول های زیستی از نظر ساختار شیمیایی و عملکردی هستند. پروتئینها در فرایندها و فعالیتهای متفاوتی شرکت دارند از جمله فعالیت آنزیمی که در آن به صورت كاتاليزورهای زیستی عمل می کنند و سرعت واکنش شیمیایی خاصی را افزایش میدهند.
نکته 2: بعضی دیگر از پروتئین ها به صورت گیرنده هایی در سطح یاخته ها قرار دارند و میکروب های خارجی، یاخته های سرطانی یا مولکول های دیگر را تشخیص می دهند. مثلا گیرنده های آنتی ژنی در سطح لنفوسیتها نمونه ای از این پروتئینها هستند.
نکته ۳: پمپ سدیم پتاسیم، پروتئيني ناقل است؛ ضمن اینکه در ساختار غشا شرکت دارد یونهای سدیم و پتاسیم را در عرض غشا جابجا می کند و فعالیت آنزیمی هم دارد که طی آن باعث تجزیه ATP میشود و تولید ADP را در سلول افزایش می دهد. پمپ سدیم - پتاسیم در غشای یاخته های عصبی و غیرعصبی یافت می شود. با هیدرولیز یک عدد ATP انرژی لازم را برای انتقال فعال (برخلاف شیب غلظت) سه عدد سدیم به خارج و دو عدد پتاسیم به داخل سلول تامین میکند. یعنی غلظت سدیم را در مایع بین سلولی و غلظت پتاسیم را در سیتوپلاسم افزایش؛ وغلظت سدیم را در سیتوپلاسم و پتاسیم در مایع بین سلولی کاهش میدهد. این پمپ در غشای یاخته های پرز جذب در جذب گلوکز و بیشتر آمینواسیدها نقش دارد.
نکته 4: پروتئین کلاژن که باعث استحکام بافت پیوندی می شود. زردپی، رباط، استخوان و پوست مقدار فراوانی از پروتئین کلاژن دارند.
نکته 5: انقباض ماهیچه ها ناشی از حرکت لغزشی دو نوع پروتئین بر روی یکدیگر یعنی اکتین و میوزین است. این دو پروتئین در تشکیل حلقه انقباضی در هنگام ستوكینز سلول های جانوری نقش دارد. پروتئین اکتین و میوزین هم در یاخته های ماهیچه ای و هم غیر ماهیچه ای یافت می شود.
نکته 6: بیشتر (نه همه) هورمونها از جمله اکسی توسین و انسولين و گلوكاگن پروتئینی هستند. برخی هورمونها، (مانند استروژن و کورتیزول و پروژسترون و تستوسترون) غير پروتئینی هستند و فاقد پیوند پپتیدی هستند. هورمونها پیام های بین یاخته ای را در بدن جانوران رد و بدل می کنند تا تنظیم های مختلف در بدن انجام شود.
نکته 7: همچنین پروتئین ها نقش های تنظیمی متعددی را در روشن و خاموش کردن ژنها در حین تمایز بر عهده دارند. مثل مهار کننده ها و عوامل رونویسی که با آنها آشنا خواهید شد. نقش های تنظیمی متعددی را در فعال و غیرفعال کردن ژنها بر عهده دارند.
ساختار آنزیمها
نکته 1: برخی پروتئینها نقش آنزیمی دارند. ولی جنس بیشتر آنزیمها از پروتئین است. در ساختار بیشتر آنزیم ها آمینواسید با پیوند پپتیدی وجود دارد. در ساختار برخی آنزیم ها آمینواسید و پیوند پپتیدی وجود ندارد.
نکته 2: برخی آنزیم ها ساختار غیر پروتئینی دارند مانند آنزیم rRNA که یک نوکلئیک اسید است و مسئول ایجاد پیوند پپتیدی است. واحدهای سازنده (مونومر) این آنزیم چهار نوع نوکلئوتید(A,G,C,U) هستند که با پیوند فسفودی استر به هم متصل هستند. در ساختار این آنزیم مونوساکارید ریبوز وجود دارد. آنزیمی که مسئول ایجاد پیوند پپتیدی است، خودش پیوند پپتیدی ندارد.
نکته ۳: همه آنزیم ها پلیمرهای زیستی هستند. بیشتر آنها پلیمری از آمینواسید و برخی پلیمری از نوکلئوتید هستند.
نکته 4: واکنش های شیمیایی در صورتی سرعت مناسب می گیرند که انرژی اولیه کافی برای انجام آن وجود داشته باشد. این انرژی را انرژی فعال سازی گویند. انجام واکنش ها در بدن موجود زنده نیز که با عنوان کلی سوخت و ساز مطرح می شوند همین طور هستند. این واکنش ها با حضور آنزیم انجام می شوند.
نکته 5: آنزيم امکان برخورد مناسب مولكولها را افزایش و انرژی فعال سازی واكنش را کاهش می دهد. همچنین با این کار سرعت واکنش هایی را که در بدن موجود زنده انجام شدنی هستند زیاد می کند. بدون آنزیم ممکن است در دمای بدن سوخت و ساز یاخته ها بسیار کند انجام شود و انرژی لازم برای حیات تأمین نشود.
نکته 6: آنزيمها می توانند خارج از سلول و یا در داخل سلول و یا در غشای سلول فعالیت کنند. آنزیم های ترشحی دستگاه گوارش مثل آمیلاز بزاق و لیپاز در خارج یاخته عمل می کنند ولی آنزیم های مؤثر در تنفس یاخته ای، فتوسنتز (آنزیم روبیسکو) و همانندسازی (هلیکاز و DNA پلیمراز) درون یاخته فعالیت می کنند. البته گروهی از آنزیم هایی مثل پمپ سدیم - پتاسيم كه نوعی کاتالیزور زیستی است، فعاليت خود را در غشا انجام میدهند.
نکته 7: توجه کنید جایگاه فعال قسمتی از آنزیم است نه قسمتی از پیش ماده. در جایگاه فعال بیشتر آنزیم ها پیوند پپتیدی یافت می شود. جایگاه فعال برخی آنزیمها فاقد آمینواسید و فاقد پیوند پپتیدی است؛ مانند آنزیم rRNA که دارای پیوند فسفودی استر است.
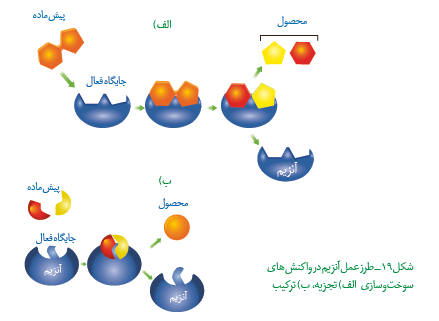
نکته 8: ترکیباتی که آنزیم روی آنها عمل می کند، پیش ماده؛ و ترکیباتی که حاصل فعالیت آنزیم هستند، فراورده یا محصول خوانده میشوند. بطور مثال پیش ماده آنزیم آمیلاز، نشاسته (پلیمری از گلوکز) و فراورده آن مالتوز و ترکیبات درشت تر است. پیش ماده آنزیم مالتاز، مالتوز (نوعی دی ساکارید) و فراورده آن گلوکز است.
عملکرد اختصاصی آنزيمها
نکته 1: جنس بیشتر آنزیمها از پروتئین است. آنزیم ها در ساختار خود بخشی به نام جايگاه فعال دارند. جایگاه فعال بخشی اختصاصی در آنزیم است که پیش ماده در آن قرار می گیرد.
نکته ۲: هر آنزیم روی یك یا چند پیش ماده خاص مؤثر است. بنابراین گفته میشود که آنزيمها عمل اختصاصی دارند. شکل آنزیم در جایگاه فعال با شکل پیش ماده یا بخشی از آن مطابقت دارد و به اصطلاح مکمل یکدیگرند.
نکته ۳: اگرچه آنزیم ها عملی اختصاصی دارند ولی برخی از آنها بیش از یک نوع واكنش را سرعت می بخشند. مثلا آنزیم دنا بسپاراز در همانندسازی هم فعالیت پلیمرازی و هم فعالیت نوكلئازی دارد. و یا آنزیم روبيسكو در کلروپلاست در فتوسنتز فعالیت کربوکسیلازی دارد و در تنفس نوری فعالیت اکسیژنازی دارد.
نکته 4: آنزیمها در همه واکنشهای شیمیایی بدن جانداران كه شركت می كنند؛ سرعت واكنش را افزایش میدهند اما در پایان واکنش ها دست نخورده باقی می مانند تا بدن بتواند از آنزیم ها بارها استفاده کند. به همین دلیل یاخته ها به مقدار کم به آنزیم ها نیاز دارند. برخی واكنشها در بدن بدون آنزیم انجام می شوند. مثلا تشکیل بیکربنات و یون هیدروژن از کربنیک اسید.
نکته 5: یک آنزیم می تواند چندین بار مورد استفاده قرار بگیرد، البته به مرور مقداری از آنها از بین می روند و یاخته مجبور به تولید آنزیمهای جدید می شود.
نکته 6: برخی آنزیمها از طریق اتصال به كوآنزيمها (تركيبات آلى كربن دار) و یا اتصال به مواد غيرآلی (مواد معدنی) مانند آهن، مس و كلسيم، تمایل خود را به پیش ماده تنظیم می کنند. بعضی آنزیم ها برای فعالیت به یون های فلزی مانند آهن، مس و یا مواد آلی مثل ویتامینها نیاز دارند. به مواد آلی (مانند ویتامین ها) که به آنزیمها کمک می کنند، کوآنزیم می گویند. به مواد معدنی (غیرآلی) مثل آهن و مس و کلسیم کوآنزیم گفته نمی شود. هر کوآنزیمی نوعی ماده آلی کربن دار است.
نکته 7: وجود بعضی از مواد سمی در محیط مثل سیانید و آرسنیک می تواند با قرار گرفتن در جایگاه فعال آنزیم. مانع فعالیت آن شود. بعضی از این مواد به همین طریق باعث مرگ می شوند.
عوامل موثر بر فعالیت آنزیمها
عوامل متعددی از جمله pH، دما، غلظت آنزیم و پیش ماده بر سرعت فعالیت آنزیمها تأثیر می گذارند.
الف) pH محیط: pH بیشتر مایعات بدن بین ۶ و ۸ است مثلا pH خون حدود ۷/۴ است. البته pH بعضی بخشها خارج از این محدوده هستند. یکی از این موارد pH ، ترشحات معده است که pH حدود ۲ دارند.
نکته 1: هر آنزیم در يك pH ویژه بهترین فعالیت را دارد که به آن pH بهینه میگویند؛ مثلا pH بهینه پپسین حدود ۲ است در حالی که آنزیم هایی که از لوزالمعده به روده کوچک وارد می شوند pH بهینه حدود ۸ دارند. پپسینوژن درون یاخته های اصلی معده به صورت غیر فعال ساخته می شود. پپسینوژن (نه پپسین) پس از ساخته شدن وارد شبکه آندوپلاسمی و سپس گلژی می شود، سپس وارد وزیکول های ترشحی می شود و سپس با اگزوسیتوز از یاخته های اصلی با صرف انرژی آزاد می شود.
نکته ۲: تغییر pH با تأثیر بر پیوندهای شیمیایی مولکول پروتئین می تواند باعث تغییر شکل آنزیم شود و در نتیجه امکان اتصال آن به پیش ماده از بین برود. در نتیجه میزان فعالیت آن تغییر می کند.
نکته 3: کربن دی اکسید می تواند با آب واکنش داده، كربنيك اسيد توليد كند و pH خون را کاهش دهد. این تغییر pH باعث تغییر ساختار پروتئین ها می شود که می تواند عملکرد پروتئین ها را مختل کند. از آنجایی كه بسیاری از فرایندهای یاخته ای را پروتنينها انجام می دهند. از بین رفتن عملکرد آنها اختلال گسترده ای را در کار یاخته ها و بافت ها ایجاد می کند. در واقع افزایش کربن دی اکسید خطرناک تر از کاهش اکسیژن است.
ب) دما: آنزیم های بدن انسان در دمای ۳۷ درجه سانتی گراد بهترین فعالیت را دارند. این آنزیم ها در دمای بالاتر ممكن است شکل غیرطبیعی یا برگشت ناپذیر پیدا کنند و غیر فعال شوند. آنزیمهایی که در دمای پايين غير فعال می شوند با برگشت دما به حالت طبیعی، می توانند به حالت فعال برگردند. دمای ۳۴ درجه برای فعالیت بیضه ها و تمایز صحیح زامه ها ضروری است.
ج) غلظت آنزيم: مقدار بسیار کمی از آنزیم کافی است تا مقدار زیادی از پیش ماده را در واحد زمان به فراورده تبدیل کند. اگر مقدار آنزیم زیادتر شود تولید فراورده در واحد زمان افزایش می یابد.
د) غلظت پیش ماده: افزایش غلظت پیش ماده در محیطی که آنزیم وجود دارد نیز می تواند تا حدی باعث افزایش سرعت شود ولی این افزایش تا زمانی ادامه می یابد که تمامی جایگاه های فعال آنزیم ها با پیش ماده اشغال شوند. در این حالت سرعت انجام واکنش ثابت می شود. افزایش غلظت کربن دی اکسید می تواند باعث افزایش فعالیت آنزیم کربنیک انیدراز در گویچه های قرمز شود.
1- در ساختار.......... پروتئینی که گازهای تنفسی را در خون منتقل می کند ................ اولین پروتئینی که ساختار آن شناسایی شد ..........
1) چهارم - همانند - زیر واحدهای تاخورده در کنار هم قرار گرفته و عمل پروتئین را مشخص می کنند.
۲) دوم - همانند- در رنجیره پلی پپیدی ساختار مارپیچی مشاهده می شود.
۳) سوم - برخلاف - با تاخوردگی بیشتر صفحات، ساختار کروی پروتئین ایجاد می شود.
۴) اول - برخلاف - هر یک از زنجیره ها توالی آمینواسیدی یکسانی نسبت به هم دارند.
2- کدام عبارت، درباره سطحی از ساختار پروتئینها درست است که تنها با برقراری پیوندهای هیدروژنی بین بخش های مختلف یک زنجیره پلی پپتیدی تشکیل می شود؟
۱) ساختار نهایی اولین پروتئینی را که ساختار آن شناسایی شد، تشکیل می دهد.
۲) همه سطوح دیگر ساختاری در پروتئین ها به این ساختار خطی بستگی دارد.
۳) ساختارهای مارپیچی و صفحه ای در پروتئینها نمونه هایی از آن می باشند.
۴) در آن با تاخوردگی بیشتر صفحات و مارپیچ ها، پروتئین به شکل های مختلف در می آید.
3- کدام عبارت، در ارتباط با نوعی از پروتئین های غیرآنزیمی گویچه قرمز که در تنظیم pH خون و انتقال گازهای تنفسی نقش دارند، نادرست است؟
۱) ساختار چهارم آن، به ترتیب قرار گرفتن آمینواسیدها به صورت خطی بستگی دارد.
۲) در ساختار نهایی آن، زیر واحدهایی تاخورده و دارای شکل های خاص، کنار هم قرار می گیرند.
۳) ساختار کروی آن در اثر نوعی پیوند که می توانند توسط آنزیم هلیکاز شکسته شوند، تشکیل می شود.
۴) در ساختار دوم آن، با تشکیل پیوند هیدروژنی میان آمینواسیدهای هر زنجیره، ساختاری مارپیچی تشکیل می شود.
4- همه کاتالیزورهای زیستی، .............
۱) درون ساختارهای غشادار یاخته جای دارند.
۲) به واکنش های درون یاخته ای سرعت می بخشند.
۳) می توانند ضمن فعالیت خود، آدنوزین تری فسفات بسازند.
۴) در پی فعالیت آنزیم های سازنده ی خود، تولید می شوند.
5- پیوندهای مؤثر در تشکیل ساختار دوم پروتئین ها ..............پیوندهای تشکیل دهنده ساختار اول آنها ..........
۱) همانند - بین گروههای مشخص کننده ویژگی های اصلی آمینواسید تشکیل می شوند.
۲) برخلاف - بین اتم های موجود در دو آمینواسید متفاوت تشکیل می شوند.
۳) همانند - در همه مولکول های پروتئینی قابل مشاهده هستند.
۴) برخلاف - همراه با آزاد شدن مولکول های آب تشکیل می شوند.
پاسخ و تحلیل تست ها در قالب فایل صوتی ساعت 9 شب سهشنبه 18 مرداد در همین مطلب بارگذاری خواهد شد.
صفحه ی اینستاگرام ما
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتوانیم ارتباطمان را با هم بیشتر کنیم و قدم به قدم کنارتان باشیم ، صفحه ی اینستاگرام را بسازیم و همراهتان باشیم . برای دیدن صفحه ما روی لینك زير كليك كنيد.
فرزین رستمی دانشجوی پزشکی دانشگاه علوم پزشکی کردستان



