سلام
در این مطلب میخواهیم با هم به جمع بندی نکات فصل 1 از صفحه 13 تا 25 (مطابق با آزمون) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران
سیده محدثه حسینی، دانشجوی دکتری تخصصی پیوسته بیوتکنولوژی دانشگاه تهران
به طور کلی هر چه شعاع یک اتم بزرگتر باشد، اندازه آن اتم نیز، بزرگتر است.
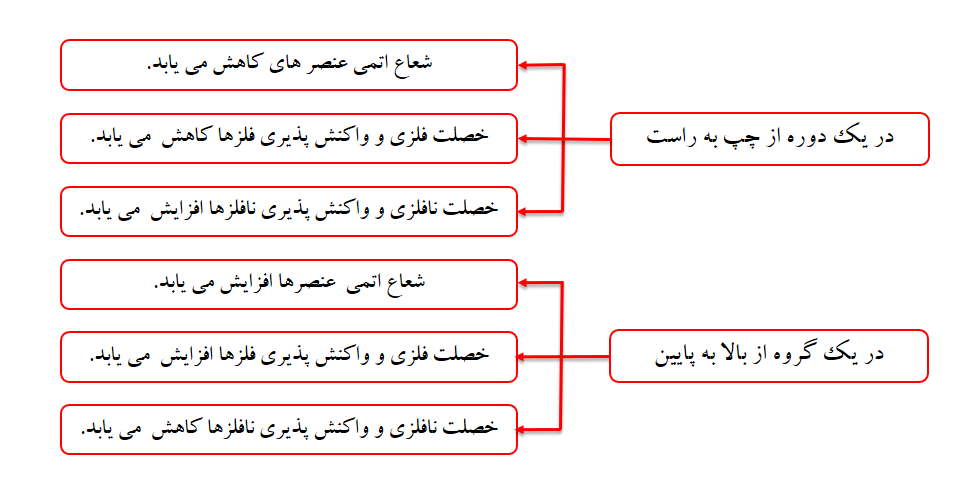
به طورکلی، شعاع اتمی عنصرهای جدول دوره ای در یک گروه از بالا به پایین افزایش می یابد؛ زیرا تعداد لایه های الکترونی بیش تر می شود.
به طور کلی در یک دوره شعاع اتمی از چپ به راست کاهش می یابد؛ زیرا در یک دوره تعداد لایه های الکترونی ثابت می ماند؛ در حالی که تعداد پروتون های هسته بر الکترون ها بیش تر شده و شعاع اتم کاهش می یابد.
دربین تمام عناصر جدول دوره ای، عنصر Fr دارای بیش ترین و عنصر H دارای کم ترین شعاع اتمی است.
توجه: از آن جا که عنصر Fr بسیار کمیاب است، می توان شعاع Cs را به عنوان بیش ترین شعاع اتمی در نظر گرفت.
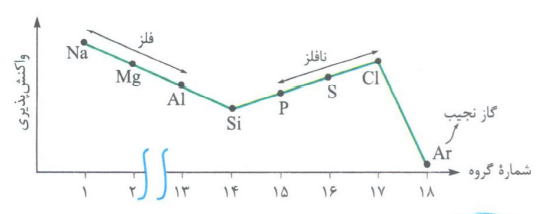
در این دوره بیشترین تفاوت شعاع اتمی دو عنصر متوالی به Si , Al مربوط است.
تغییرشعاع اتمی در دورۀ سوم عدد اتمی
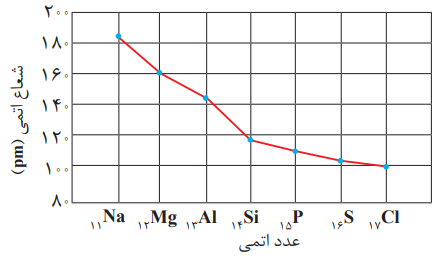
باتوجه به نمودار می توان فهمید که شیب تغییرات شعاع در ابتدا (سمت چپ) تناوب بیش تراز شیب آن ها در انتها (سمت راست) تناوب است که این موضوع به دلیل افزایش دافعه بین الکترون ها در عناصر انتهایی تناوب می باشد.
با توجه به روند تغییر شعاع اتمی در یک گروه و دوره، هر چه عنصری در جدول دوره ای، سمت چپ تر و پایین تر، شعاع آن بزرگتر است و بالعکس.
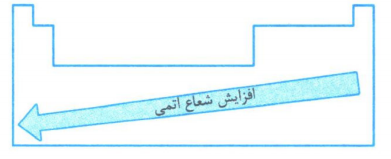
رابطه خصلت فلزی و نافلزی با شعاع اتم ها
هر چه شعاع اتم بزرگتر اتم آسان تر الکترون از دست می دهد و خصلت فلزی افزایش می یابد.
خصلت فلزی عناصر گروه اول از عناصر هم دوره گروه دوم بیش تر است که این موضوع به دلیل کم تر بودن تعداد الکترون ظرفیت عناصر گروه اول (1 الکترون) نسبت به تعداد الکترون های لایه ظرفیت گروه دوم (2 الکترون) می باشد.
به طور کلی هر چه شعاع اتمی کوچکتر می شود، اتم آسان تر الکترون می گیرد، بنابراین دلیل اینکه خصلت نافلزی در یک گروه از بالا به پایین کاهش می یابد، افزایش شعاع اتم می باشد.

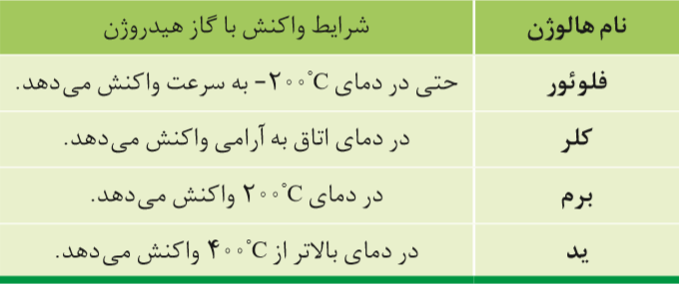
فلزات واسطه
دسته ای از عناصر جدول دوره ای می باشند که در مرکز جدول دوره ای قرار دارند و زیر لایهd در آن ها در حال پر شدن است و دارای خصوصیات زیر هستند:
1-همگی فلز هستند و دارای رسانایی الکتریکی و گرمایی می باشند.
2-اغلب این فلز ها در طبیعت به شکل ترکیب های یونی مانند اکسیدها، کربنات ها و ....یافت می شوند.
3-یون های فلزات واسطه و ترکیبات یونی دارای این یون ها اغلب رنگی هستند. به عنوان مثال یون مس II ، آبی رنگ است.
4-مهم ترین فلزات واسطه مربوط به دوره ی چهارم جدول دوره ای هستند که عدد اتمی آن ها 21 تا 30 می باشد.
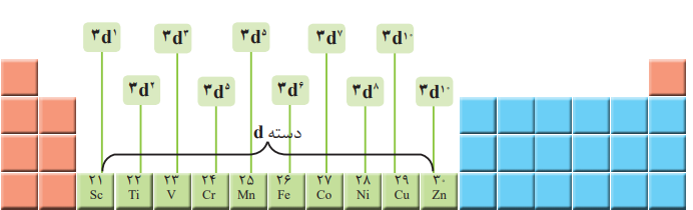
طلا 79Au فلزی ارزشمند و گران از دسته ی dجدول دوره ای است که علاوه بر ویژگی های مشترک فلزها، ویژگی های منحصر به فردی دارد.
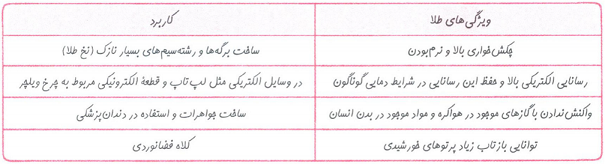
برخی از فلزهای واسطه که بیش ازیک نوع کاتیون دارند.

تست 1:

تست 2:


مقایسه ی واکنش پذیری عناصر
واکنش پذیری هر عنصر به معنای تمایل اتم آن به انجام واکنش شیمیایی است. هر چه واکنش پذیری اتم های عنصری بیشتر باشد، در شرایط یکسان تمایل آن برای انجام واکنش و تبدیل شدن به ترکیب بیشتراست.
* درهر واکنش شیمیایی که به طور طبیعی انجام می شود، واکنش پذیری فراورده ها از واکنش دهنده ها کمتر است؛ پس اگر یک واکنش به ما بدهند که در دو طرفش به عنصر آزاد وجود داشته باشد و بگن که این واکنش به طور طبیعی انجام میشه، ما خیلی سریع می تونیم واکنش پذیری دو عنصرآزاد در دو طرف معادله را با هم مقایسه کنیم:
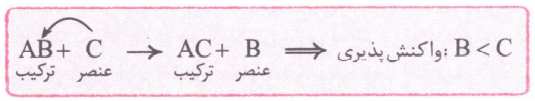
در معادله کلی بالا، واکنش پذیری Cاز Bبیشتر بوده است؛ به همین دلیل میل بیشتری به تشکیل ترکیب داشته؛ از این رو با انجام واکنش، جایش را با B عوض می کند. واکنش زیر به طور طبیعی انجام می شود.
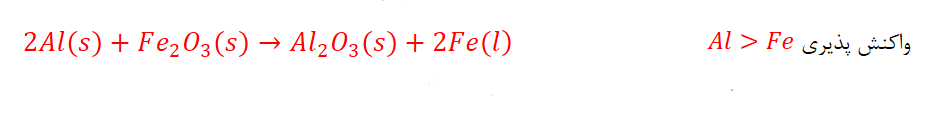
واکنش پذیری فراورده (Fe)از واکنش دهنده (Al) کم تراست.
واکنش ترمیت ازآهن مذاب تولید شده برای جوش دادن خطوط راه آهن استفاده می شود.
Al> C > Zn > Fe > Cu, Ag, Auفلز های گروه 1 و 2 :واکنش پذیری
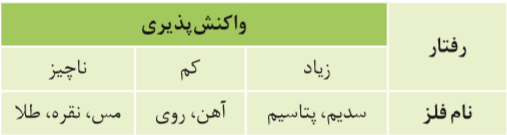
درشرایط یکسان تمایل سدیم و پتاسیم برای تبدیل شدن به کاتیون بیشتر از فلزهای دیگراست.
هرچه واکنش پذیری فلز بیشتر باشد، در هوای مرطوب سریع تر واکنش می دهد.
تامین شرایط نگه داری برای سدیم و پتاسیم دشوارتر از بقیه ی فلز هاست چون تمایل به ایجاد ترکیب دارند.
به طور کلی در هر واکنش شیمیایی که به طور طبیعی انجام می شود، واکنش پذیری فرآورده ها از واکنش دهنده ها کم تر است.

به مقدار فرآورده مورد انتظار در هر واکنش، مقدار نظری وبه مقدار فرآورده ای که در عمل تولید می شود، مقدار عملی گفته می شود.
تست 3:

تست 4:

تست 5:

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی


