سلام
در این مطلب میخواهیم با هم به جمع بندی نکات فصل 1 از صفحه 16 تا 44 (مطابق با آزمون جامع) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
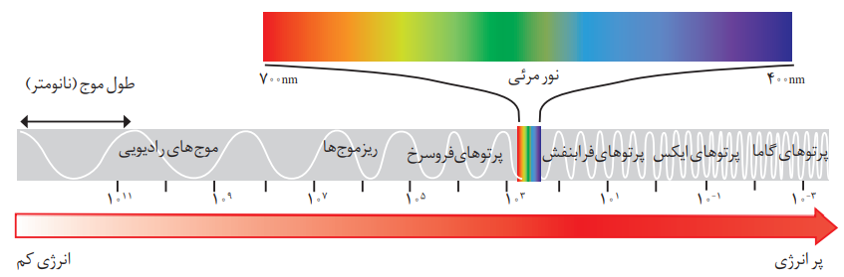
پرتوهای الکترومغناطیس
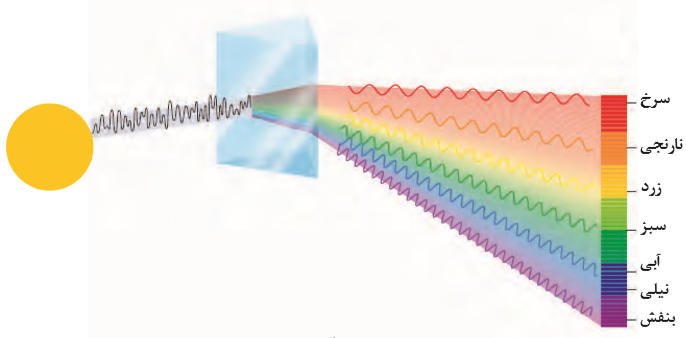
نکته: میزان شکست نور با طول موج رابطه ی عکس دارد، مثلا شکست نور بنفش از نور قرمز بیش است.
چشم انسان یک محدوده ی بسیار کوچک از نور یعنی طول موج 400 – 700 نانومتر را می تواند ببیند که به آن گستره ی مرئی گفته می شود و شامل رنگ های سرخ، نارنجی، زرد، سبز، آبی، نیلی و بنفش است.
به طور کلی هر چه طول موج پرتویی کوتاه تر باشد، انرژی بیش تری با خود حمل می کند. به عنوان مثال انرژی نور آبی از نور سرخ بیش تراست.
امواج رادیویی < ریز موج ها < فروسرخ < نور مرئی < فرابنفش < ایکس < گاما : انرژی
طیف نشرخطی عنصرها
تجربه نشان می دهد که بسیاری از نمک ها، شعله ی رنگی دارند و اگر مقداری از محلول آن ها را روی شعله بپاشیم، رنگ شعله تغییر می کند.
رنگ شعله فلزها با رنگ شعله ی ترکیب های دارای این فلزها، مشابه است.
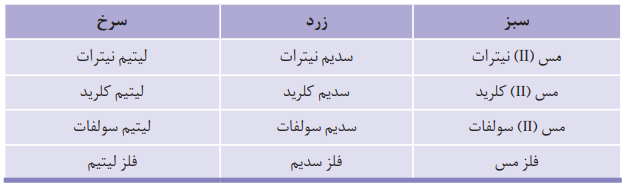
به فرآیندی که در آن یک ماده با جذب انرژی از خود نور (پرتوهای الکترومغناطیس) منتشر می کنند، نشر نور گفته می شود.
اگر نور نشرشده از یک عنصر یا ترکیب دارای آن عنصر را از منشور عبور دهیم، الگویی شامل خط ها یا نوار های مجزای رنگی به وجود می آید که به آن طيف نشری خطی می گویند.
طیف نشری خطی هر عنصر مختص همان عنصر است و می توان از آن برای شناسایی عناصر استفاده کرد.
طیف نشری خطی هیدروژن دارای 4 خط به رنگ های بنفش، آبی، سبز و قرمز می باشد.
نکته: هلیم، لیتیم و نئون به ترتیب دارای 9، 4 و 22 خط در گستره ی مرئی خود می باشند.
مدل کوانتومی اتم
1- در این مدل اتم مانند کره ای در نظر گرفته می شود که هسته در فضایی بسیار کوچک در مرکز آن قرار دارد.
2- الکترون ها در فضایی بسیار بزرگ تر و در لایه هایی اطرف هسته توزیع می شود.
(لایه ها به ترتیب از طرف هسته به بیرون با شماره های 1، 2 و ... شماره گذاری می شوند.)
3- شماره هر لایه با (n) عدد کوانتومی اصلی، نمایش داده می شود.
4- در ساختار لایه ای، بخش های پر رنگ تر، مهم ترین بخش از یک لایه را نشان می دهند که الکترون بیش تر وقت خود را در آن فاصله سپری می کند. (الکترون ها مابقی وقت خود رامی توانند در همه ی نقاط پیرامون هسته حضور داشته باشند.)
5- در این مدل، داد و ستد انرژی به صورت کوانتومی صورت می گیرد. یعنی الکترون هنگام انتقال از یک لایه به لایه دیگر انرژی را به صورت پیمانه ای یا بسته ای جذب یا نشرمی کند.
توجه : کوانتومی بودن داد و ستد انرژی به معنای « پله پله بودن » آن است. یعنی الکترون نمی تواند به هنگام بالا رفتن و پایین آمدن از لایه ها در هر جایی قرار بگیرد و فقط می تواند بر روی لایه قرار گیرد، آن هم با جذب و یا نشر مقدار انرژی معین و کافی!!
نکته: از آنجا که انرژی داد و ستد شده هنگام انتقال الکترون ها کوانتومی است، ساختار لایه ای اتم را مدل کوانتومی نیز نامیده اند.
نکته: هر چه میزان انرژی جذب شده بیش تر باشد، الکترون به لایه های بالاتر می رود و به هنگام بازگشت انرژی بیشتری آزاد می کند.
توزیع الکترون ها در لایه ها و زیر لایه ها
در مدل کوانتومی اتم، به هر نوع زیر لایه، عدد کوانتومی خاصی نسبت می دهند که با I نشان داده می شود و عدد کوانتومی فرعی نامیده می شود. برای هر یک از مقادیر عددی I، معمولا حروف در نظر گرفته می شود که به صورت جدول زیر است:
حداکثر گنجایش هر لایه از رابطه (2n2) و حداکثر گنجایش هر زیر لایه از رابطه (4I+2) به دست می آید.
قاعده ی آفبا
روند پر شدن زیر لایه ها در اطرف هسته تنها به عددکوانتومی اصلی وابسته نیست بلکه از قاعده کلی به نام آفبا پیروی می کند. برطبق این قاعده، هنگام افزودن الکترون به زیرلایه ها، نخست زیرلایه های نزدیک تر به هسته پر می شوند که دارای انرژی کم تری هستند و سپس زیر لایه های بالاتر پر خواهند شد.
ترتیب پر شدن زیر لایه ها به صورت مقابل است:
1s → 2s → 2p → 3s → 3p →4s → 3d → 4p→ 5s → 4d → 5p → 6s → 4f → 5d →6p → 7s → 5f → 6d → 7p
نکته: به طور کلی هر چه مجموع n و I یک زیر لایه کوچکتر باشد، زیر لایه دارای انرژی کم تری است و زودتر پر می شود.
نکته: اگر مجموع n و I دو زیر لایه یکسان باشد، زیر لایه ای که دارای n کوچکتری است، انرژی کمتری دارد و زودتر پر می شود.
ترتیب پر شدن زیر لایه ها: ( n نشان دهنده شماره دوره است.)
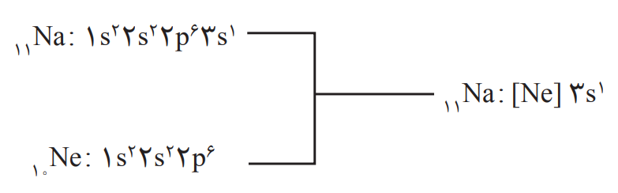
آرایش الكترونی فشرده (شیوۀ دیگر آرایش الکترونی اتم ها)
در این آرایش الكترونی از نماد گاز نجیب استفاده شده است. برای دست یابی به آرایش فشرده، نخست آرایش اتم مورد نظر به صورت گسترده نوشته می شود؛ سپس بخشی از آرایش الكترونی كه همانند آرایش الكترونی یك گاز نجیب است با عبارت [ ] نماد شیمیایی گاز نجیب جایگزین می شود. برای مثال:
تعیین موقعیت عنصرها در جدول دوره ای عناصر
با استفاده از آرایش الکترونی عناصر می توان شماره دوره و گروه عنصر را به ترتیب زیر معین کرد.
آ) بزرگ ترین (n) عدد کوانتومی اصلی در آرایش الکترونی نشان دهنده ی شماره دوره آن است.
ب) برای تعیین شماره گروه عناصر، سه حالت پیش می آید:
1) اگر عنصر متعلق به دسته (s) باشد، شماره گروه آن برابر با توان (s) است.
2) اگر عنصر متعلق به دسته (p) باشد، شماره گروه آن برابر با (توان12 + p) است.
3) اگر عنصر متعلق به دسته (d) باشد، شماره گروه آن برابر با (توانd + توان s) است.
نکته: باتوجه به این که آخرین الکترون وارد شده به اتم، در کدام زیر لایه قرار می گیرد، عناصر در چهار دسته ی S، P، d، f، جای می گیرند و تعداد الکترون های ظرفیت این عناصر (به جز دسته ی f) به صورت زیر است:
نکته: لایه طرفیت، بیرونی ترین لایه ی اتم و لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کند.
آرایش الکترون – نقطه ای عناصر هم گروه با هم یکسان است. ( به جز گروه 18 که آرایش الکترون نقطه He با سایر عناصر گروه متفاوت است.)
توجه کنید که در آرایش هلیم، 2 الکترون باید به صورت جفت نمایش داده شوند، نه تکی.
بیشترین تعداد الکترون های تکی مربوط به گروه 14جدول دوره ای هستند.
تست های منتخب؛ (تست های زیر را حل کنید و پاسخ آن ها را در کامنت ها به اشتراک بگذارید!)
تست 1

تست 2

تست 3

تست 4

تست 5

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


