سلام
در این مطلب میخواهیم با هم به جمع بندی نکات فصل 3 شیمی 3 (مطابق با آزمون 31 اردیبهشت) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
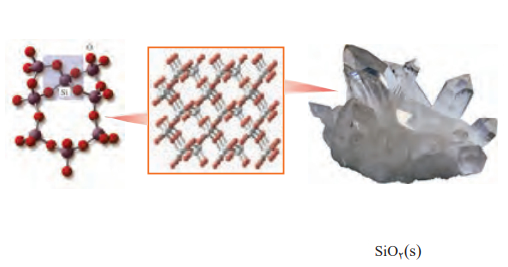
ساختار ذره ای مواد سازنده ی خاک رس، پس از جدا و خالص سازی، در حالت جامد از الگو های زیر تبعیت می کنند:
1-سیلیس: جامد کووالانسی 2- یخ: جامدمولکولی 3- طلا: جامد فلزی 4- سایر فلزات: جامد یونی
جامد مولکولی
شبکه بلور این جامدات از مولکول های مجزا و مستقل تشکیل شده است و نیروهای بین مولکولی (نیرو های ضعیف واندروالسی و یا پیوند های هیدروژنی) این مولکول ها را در شبکه بلور کنار هم نگه می دارند.
1. دمای ذوب این نوع مواد، به دلیل جاذبه های ضعیف بین مولکولی پایین است.
2. ترکیب هایی که در دما و فشار اتاق مایع هستند، جز مواد مولکولی به شمار می روند.
جامد های کووالانسی
1. ساختار به هم پیوسته و غول آسایی از اتم ها با پیوند های اشتراکی در سرتاسر بلور است.
2. درچنین ساختاری مولکول های مجزا وجود ندارد و تمامی پیوند ها از نوع اشتراکی اند.
3. مواد کووالانسی در دما و فشار اتاق به حالت جامد هستند، به همین دلیل آن ها جامد کووالانسی می نامند.
4. این نوع جامدها دمای ذوب بالایی دارند، سخت و دیر گدازند و می توانند دو بعدی یا سه بعدی، رسانا یا نارسانا باشند.
5. عنصرهای اصلی سازنده ی جامدهای کووالانسی در طبیعت، کربن و سیلیسیم هستند.
رفتار مولکول ها و توزیع الکترون ها
ساده ترین مولکول ها از دو اتم تشکیل شده اند. اگر دو اتم متصل به هم باشند، جور هسته و اگر یکسان نباشند، ناجور هسته نامیده می شوند.
1. مولکول های جور هسته، گشتاور دو قطبی صفر دارند و در میدان الکتریکی جهت گیری نمی کنند. چنین مولکول هایی همگی ناقطبی هستند. در این مولکول ها احتمال حضور جفت الکترون پیوندی در فضای بین دو هسته بیشتر است. از این رو احتمال حضور آن ها روی هسته ها یکسان و متقارن است. (فاقداتم با بار جزئی)
2. در مولکول های ناجور هسته، توزیع الکترون ها یکنواخت نبوده و تراکم بار روی آن ها یکی نیست. احتمال حضور جفت الکترون های پیوندی پیرامون هسته اتمی که خاصیت نافلزی بیشتری دارد، بالاتر است. از این رو احتمال حضور الکترون های پیوندی روی هسته ها یکسان و متقارن نیست. در چنین مولکول هایی گشتاور دوقطبی بزرگتر از صفر است، یعنی مولکول قطبی است و در میدان الکتریکی جهت گیری می کنند. (اتم ها بار جزئی مثبت و منفی دارند.)
در این مولکول ها، به اتمی که تراکم بار الکتریکی روی آن بیشتر است، بار جزئی منفی و به اتم دیگر بار جزئی مثبت می دهند.
نکته ی مهم: هرچه تفاوت بین نقطه ذوب و جوش یک ماده خالص بیشتر باشد، آن ماده در گستره ی دمایی بیشتری به حالت مایع بوده و نیرو های جاذبه میان ذره های سازده مایع قوی تر است.
مقایسه نقطه ذوب و جوش: NaCl> HF > N2
تفاوت دمای ذوب و جوش: NaCl> HF > N2
شعاع یونی
وقتی اتمی تبدیل به یون می شود، شعاع آن تغییر می کند. به این ترتیب که اگر در این تبدیل، الکترون از دست بدهد و کاتیون حاصل شود، شعاع یون حاصل از شعاع اتم کمتر است. اما اگر در این تبدیل، الکترون گرفته و آنیون حاصل شود، شعاع یون حاصل از شعاع اتم بیش تر است.

نکات مربوط به جدول بالا
1. شعاع یونی در یک گروه از بالا به پایین افزایش می یابد.
Li > Na > K > Rb >Cs
F > Cl > Br > I
2. شعاع یونی در یک تناوب بر اساس گروه های اصلی به صورت زیر مقایسه می شود:
15 > 16 > 17 > 1 > 2> 13
3. در مقایسه ی شعاع گونه هایی که همگی تعداد الکترون برابری دارند، شعاع آنیون ها از اتم ها و شعاع اتم ها از کاتیون ها بیش تر است و هر چه مقدار بار منفی آنیون بیش تر و هر چه مقدار بار مثبت کاتیون بیشتر باشد، این نسبت، مقدار بار یون به شعاع آن است.
P > S > Cl > Ar >K > Ca
گرمای مصرف شده در فضار ثابت برای تبدیل یک مول جامد یونی به یون های سازنده اش در حالت گازی، آنتالپی فروپاشی شبکه نامیده می شود.

نکاتی در رابطه با فروپاشی شبکه
1. (فروپاشی) همواره مثبت است؛ یعنی فرآیند فروپاشی شبکه بلور با مصرف انرژی همراه است.
2. هرچه چگالی بار یون های سازنده شبکه بلور بیش تر باشد (فروپاشی) بیشتر است. برای نمونه انرژی لازم برای فروپاشی یک مول از شبکه بلوری پتاسیم برمید، کم تر است.
3. آنتالپی فروپاشی شبکه با بار الکتریکی کاتیون و آنیون رابطه مستقیم دارد.
4. روش مقایسه انرژی فروپاشی شبکه بین چند ترکیب مختلف به صورت زیر است:
آ) هر ترکیبی که حاصل ضرب (بار کاتیون × بار آنیون × مجموع تعداد کاتیون ها و آنیون ها در فرمول شیمیایی) آن بیش تر است، (فروپاشی) بیشتر است.
ب) در مواردی که این حاصل ضرب بین چند ترکیب یونی برابر است، ترکیب یونی که شعاع یون های سازنده ی آن کوچکتر باشد، (فروپاشی) بیشتر است.
فلز ها
شبکه بلور جامدهای فلزی آرایش منظمی از یون های مثبت فلزی در سه بعد است و دریایی از الکترون های ظرفیت (سست ترین الکترون های موجود در اتم ها) بین این یون ها در حرکت و جریان است و باعث ایجاد جاذبه هایی قوی موسوم به پیوند فلزی می شوند. پیوند های فلزی در این جامدات محکم و قوی است و باعث می شود.
این جامدات پایداری و نقطه ذوب و جوش بالایی داشته باشند. شکل پذیری (ورقه ورقه شدن) و رسانایی الکتریکی از دیگر ویژگی های جامدات فلزی است.

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


