حتماً تا به حال شناور ماندن روغن بر روي آب را ديدهايد، نظير اين حالت را شايد در لامپهاي لاوا که در آن يک مايع رنگي به بالا و پاين حرکت ميکند، ديده باشيد.
اين لامپها از دو مايع مخلوط نشده با چگالي متفاوت تشکيل شدهاند. پس به نظر ميآيد که در اين گونه موارد، ماده حلشونده، غير قابل حل در حلال است؛ يعني به بيان شيميايي، انحلالپذيري آن تقريباً صفر است. براي همين است که هيچ کدام از مواد لامپ با هم ترکيب نميشوند.

اصطلاحاتي که در بحث انحلال مهم هستند:
هنگامي که مادهاي مانند نمک را در آب حل مي کنيم، آب در نقش حلال، نمک در نقش ماده حلشونده و ترکيب آب و نمکي که در آن حل شده است، محلول ناميده ميشود.

انحلالپذيري يک ماده حلشونده، غلظت محلول اشباع شده آن است.

محلول اشباع: محلولي است که بالاترين مقدار از ماده حلشونده در حلال در يک دماي مشخص در آن حل شده است و آهنگ انحلال با آهنگ رسوب آن با هم برابر است.
محلول غير اشباع: محلولي است که ماده حلشونده به طور کامل در حلال، حل شده است.

محلول فوق اشباع: محلولي است که مقدار ماده حلشده از بالاترين حد انحلال، خيلي بيشتر است. در اين حالت، مقداري از ماده حلشونده به صورت حلنشده ممکن است باقي بماند.
اصل لوشاتليه: اين اصل بيان ميکند هنگامي که يک سيستم را از تعادل شيميايي خارج کنيم، سيستم خود را به حالتي پيش خواهد برد که اثر تغييرات داده شده را تا حد ممکن کم کند.

واکنش گرماگير: واکنشي که در آن گرما جذب ميشود( ΔH>0 ).
واکنش گرمازا: واکنشي که در آن گرما آزاد ميشود( ΔH < 0 ).
انحلالپذيري:
تعريف: انحلالپذيري به صورت بالاترين مقداري که ماده حلشونده ميتواند در مقدار مشخصي از حلال در حالت تعادل، حل شود؛ تعريف ميشود.
در چنين تعادلي، ميتوان از اصل لوشاتليه استفاده کرد تا عوامل تأثيرگذار بر انحلالپذيري را بهتر توضيح داد. البته توجه داشته باشيد که انحلال يک فرايند فيزيکي است (يعني تغيير در حالت شيميايي مواد به وجود نميآيد) و مقدار آن مي تواند اندازهگيري شود.

عوامل مۆثر بر انحلالپذيري:
رابطه ماده حلشونده – حلال: جاذبه قوي حلال و ماده حلشونده، باعث انحلالپذيري بيشتر ميشود. به همين ترتيب اگر جاذبه کمي بين مولکولهاي حلال و ماده حلشونده وجود داشته باشد، به همان نسبت، انحلالپذيري کم تر خواهد بود. براي فهم بهتر اين مطلب به مطلب "حالتهاي ترکيبات يوني" نيز مراجعه کنيد.
مواد قطبي در حلالهاي قطبي بهترحل ميشوند. در حالي که مواد غير قطبي در مواد غيرقطبي بهتر حل ميشوند. حل شدن يک ماده قطبي در حلال غير قطبي (يا برعکس آن) به صورت غير قابل انحلال است و يا به مقدار بسيار جزئي انحلال وجود دارد.
اين قانون را همواره به ياد داشته باشيد:
مواد مشابه همديگر را حل ميکنند.
اثر يون مشترک:
اين اثر بيان ميکند که وقتي به سيستم در حال تعادل شيميايي، نمکي اضافه ميشود که داراي همان يون موجود در محلول تعادلي است، انحلالپذيري ترکيب يوني کاهش پيدا ميکند.

با يک مثال اين مطلب را بهتر متوجه خواهيد شد:
در يک آزمايش، يک ترکيب يوني که انحلال پذيري کمي دارد مانند CaSO4 به آب اضافه مي کنيم. معادله يوني خالص براي تعادل شيميايي نهايي به صورت زير خواهد بود:

سولفات کلسيم انحلالپذيري کمي دارد؛ به اين معنا که در حالت تعادل، بيشتر کلسيم و سولفاتها در حالت جامد سولفات کلسيم قرار دارند و کاملاً حل نشدهاند.
حال اگر ترکيب يوني انحلالپذير سولفات مس (CuSO4) را به محلول قبلي اضافه کنيم؛ تنها اثر مهم اين ماده انحلالپذير روي معادله يوني خالص، افزايش دادن يونهاي سولفات SO4- است.
يونهاي سولفات جدا شده از سولفات مس در حالت دوم در ترکيب مختصر تجزيه شده سولفات کلسيم نيز وجود داشتند. بنابراين اين افزايش در يونهاي سولفات، باعث يک تغيير در سيستم تعادلي قبلي ميشود. اصل لوشاتليه نيز مي گويد اگر تغييري به سمت محصولات يک واکنش تعادلي وارد شود، معادله براي کاهش اثر اين تغييرات به سمت واکنشدهندهها بايد پيش رود. در اين حالت که معادله به سمت واکنشدهندهها پيشرفت ميکند، طبق معادله بالا ميبينيم که انحلالپذيري کم سولفات کلسيم خيلي بيشتر کاهش مييابد.

دما:
تغييرات دما حتما روي انحلالپذيري مواد جامد، مايع و گاز تأثير مي گذارد. البته اين اثرات فقط به طور محدود براي گازها و جامدات تعيين شده اند.
مواد جامد:
اثر دما روي مواد جامد، بسته به اين که واکنش گرماگير است يا گرمازا، فرق مي کند. با استفاده از اصل لوشاتليه مي توانيم اثر دما روي هر دو واکنش را معين کنيم.

در يک واکنش گرماگير (که گرما روي طرف واکنش دهنده هايي که جامدند، اعمال مي شود)، افزايش دما تغييري روي طرف واکنش دهنده ها ايجاد مي کند؛ طبق اصل لوشاتليه براي تعادل دوباره، معادله به سمت طرف محصولات پيش مي رود. با اين کار، ماده جامد بيش تر تجزيه مي شود و تعادل جديدي حاصل مي شود که در آن انحلال پذيري جامد افزايش يافته است.
در واکنش گرمازا (که گرما به قسمت محصولات واکنش که همان يون هاي تجزيه شده مواد جامد واکنش دهنده هستند، اعمال مي شود)، افزايش دما در قسمت محصولات، يک تغيير در حالت تعادلي واکنش ايجاد مي کند، طبق اصل لوشاتليه واکنش به سمت واکنش دهنده ها پيش مي رود. با اين جابجايي و تعادل جديد، مقدار کمي از مواد جامد واکنش دهنده تجزيه مي شوند و انحلال پذيري کاهش پيدا مي کند.
مايعات:
تغييرات دما، هيچ رفتار مشخصي روي انحلال پذيري مايعات ندارد. شايد هيچ گاه ترکيب حلال – حل شونده اي که هر دو به صورت مايع هستند، با مشکل مواجه نشود.
گازها:
در مورد مواد، نخست به ياد داشته باشد که دما، مقياس و ميزاني از انرژي جنبشي متوسط ماده را نشان مي دهد. وقتي دما افزايش پيدا مي کند، حرکت مولکول هاي گاز بيش تر شده و بنابراين احتمال اين که ذرات گاز حل شده در مايع، به فاز گازي فرار کنند بيش تر مي شود و ذرات گاز موجود، کم تر حل مي شوند.

بنابراين افزايش دما به معناي انحلالپذيري کمتر و کاهش دما به معناي انحلالپذيري بيشتر براي گازهاست.
طبق اصل لوشاتليه، اين رفتار گازها را بهتر مي توان فهميد. ابتدا دقت کنيد که حل شدن گاز در مايع معمولا گرمازا است؛ بنابراين افزايش دماي اعمال شده به سمت محصولات اين واکنش، يک تغيير در سيستم به وجود مي آورد. پس سيستم به سمت واکنش دهنده ها پيش مي رود تا اين تغيير را کم تر کند. در نتيجه، غلظت تعادلي ذرات گاز در فاز گازي افزايش پيدا خواهد کرد و انحلال پذيري گاز، کم تر خواهد شد. برعکس اين حالت نيز براي کاهش دما در سمت محصولات براي گاز اتفاق ميافتد. يعني کاهش دما طبق اصل لوشاتليه باعث افزايش انحلال پذيري گاز ميشود.

اثر فشار بر روي انحلالپذيري مواد جامد و مايع بسيار کوچک است؛ بنابراين از اثر فشار بر روي گازها صحبت خواهيم کرد:
در مورد گازها با ترکيب اصل لوشاتليه و قانون هنري ميتوان اثر فشار را روي انحلالپذيري آنها بررسي کرد. قانون هنري بيان ميکند هنگامي که دما ثابت است، انحلالپذيري گاز با فشار جزئي آن متناسب است:
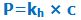
که p فشار جزئي گاز موجود در بالاي مايع است، kh ثابت هنري و c غلظت گاز در مايع است.

در دماي ثابت، از اين فرمول مي توان نتيجه گرفت؛ زماني که فشار جزئي کاهش پيدا مي کند، غلظت گاز در مايع نيز کاهش پيدا خواهد کرد و اين به معناي کاهش انحلال پذيري نيز هست و برعکس.
سيستمي را در نظر بگيريد که در آن مقداري گاز در مايع حل شده است. افزايش فشار باعث افزايش فشار جزئي (فشار وارد بر هر قسمت از اين ترکيب) مي شود و گاز بيش تر متراکم مي شود. افزايش فشار جزئي به اين معناست که ذرات گازي بيش تري وارد مايع مي شوند (گاز بالاي مايع در اين حالت، کم تر مي شود) و فشار جزئي نيز با اين تغيير، کاهش پيدا مي کند؛ يعني براي کم کردن اثر اين تغيير در افزايش فشار، واکنش خود را به گونه اي تغيير مي دهد که انحلال پذيري بيش تر شود.

اگر در همين حالت، فشار وارد بر سيستم را کاهش مي داديم، مولکول هاي گازي بيش تري از مايع فرار مي کردند و براي همين انحلال پذيري کم تر مي شد.
براي مشاهده فيلم مربوط به انحلال پذيري و آهنگ واکنش اين جا را کليک کنيد.
براي فهم مطالب بالا بهتر است اين واکنش تعادلي را با هم بررسي کنيم:
انحلال پذيري دي اکسيد کربن با تغييرات زير چه تغييري مي کند؟
الف) دما افزايش پيدا کند.
ب) فشار و دما افزايش پيدا کنند.
ج) فشار، افزايش ولي دما کاهش پيدا کند.
د) فشار کاهش پيدا کند.
جواب:
الف) واکنش گرما زا است؛ بنابراين افزايش در دما به معناي کاهش انحلال پذيري است.
ب) افزايش در هر دو عامل فشار و دما در اين واکنش به معناي انحلال پذيري بيش تر است.
ج) با اطلاعات داده شده، نمي توان فهميد انحلال پذيري چه تغييري مي کند.
د) افزايش در فشار، باعث وارد شدن مولکول هاي گازي بيش تري به مايع مي شود تا فشار جزئي را کاهش دهد؛ بنابراين انحلال پذيري افزايش پيدا مي کند.


