سلام کانونی عزیز
در این مطلب مفاهیم و نکات فصل قدر هدایای زمین را بدانیم ،بخش فلز های واسطه را مرور میکنیم.
🔵ویژگیهای مطلب🔵
1- درسنامه و نکات فصل اول شیمی دهم
2- 5 تست شناسنامه دار
3-پاسخ تشریحی
| مولف: علیرضا رفتاری رتبه ۱۱ کشوری کنکور ریاضی ۱۴۰۴ |

در ابتدا سوالاتی که از این مبحث در امتحان نهایی آمده است را میبینیم.


🟣ساختار اتم🟣
اینجا با دو مدل اتمی آشنا می شویم: 1- مدل بور 2-مدل کوانتمی
1-مدل بور: در طیف نشری خطی عنصر ها، هر نوار یا خط، نوری با طول موج و انرژی معین را نشان می دهد. بور با بررسی تعداد و جایگاه خط های موجود در طیف نشری خطی اتم هیدروژن (ساده ترین اتم) و در نظر گرفتن اینکه الکترون در اتم هیدروژن انرژی معینی دارد، توانست با مدل خود، طیف نشری خطی اتم هیدروژن را به خوبی توضیح دهد. در مدل بور، الکترون ها در مسیرهای دایره ای به نام مدار به دور هسته در حال چرخش هستند. مدل بور به جز توجیه طیف نشری خطی عنصر هیدروژن، توانایی توجیه طیف نشری خطی دیگر عنصرها را نداشت.
2- مدل کوانتمی: پس از بور، دانشمندان برای توجیه طیف نشری خطی دیگر عنصرها و چگونگی نشر نور از اتم ها، ساختار لایه ای برای اتم پیشنهاد دادند. در این مدل اتم را کره ای در نظر می گیرند که هسته در فضایی بسیار کوچک و در مرکز آن جای دارد و الکترون ها در فضایی بسیار بزرگتر و در لایه های پیرامون هسته توزیع می شوند
ترتیب شماره گذاری لایه ها از هسته به سمت بیرون است. شماره هر لایه را با n نشان می دهند که n عدد کوانتومی اصلی نامیده می شود. هر چه الکترون در لایه دورتری از هسته باشد، انرژی آن بیشتر است.
در ساختار لایه ای (مدل کوانتومی،) برای حرکت الکترون به دور هسته، مسیر دقیقی توصیف نمی شود. در این مدل با احتمال حضور الکترون در فضای معین سروکار داریم؛ به این معنا که الکترون در هر لایه ای که باشد، در همه نقاط پیرامون هسته حضور می یابد اما در محدوده یاد شده (یعنی در یک لایه) احتمال حضور بیشتری دارد
در ساختار لایه ای، انرژی الکترون ها در لایه ها و بنابراین داد و ستد انرژی هنگام انتقال الکترون از یک لایه به لایه دیگر، کوانتومی است. (یعنی هر مقداری را نمی تواند داشته باشد)
🟣مفهوم کوانتمی بودن🟣
کمیت هایی که تنها می توانند مقادیر معینی (مضرب صحیحی از یک مقدار معین) را داشته باشند کیمت گسسته یا کوانتمی می نامند.
انرژی مانند ماده در نگاه ماکروسکوپی، پیوسته اما در نگاه میکروسکوپی گسسته یا کوانتومی است نکته مهم و جالب توجه در این مدل، کوانتومی بودن دادوستد انرژی هنگام انتقال الکترون از یك لایه به لایه دیگر است. در واقع الکترون هنگام انتقال از یك لایه به لایه دیگر، انرژی را به صورت پیمانه ای یا بسته های معین، جذب یا نشر می كند.
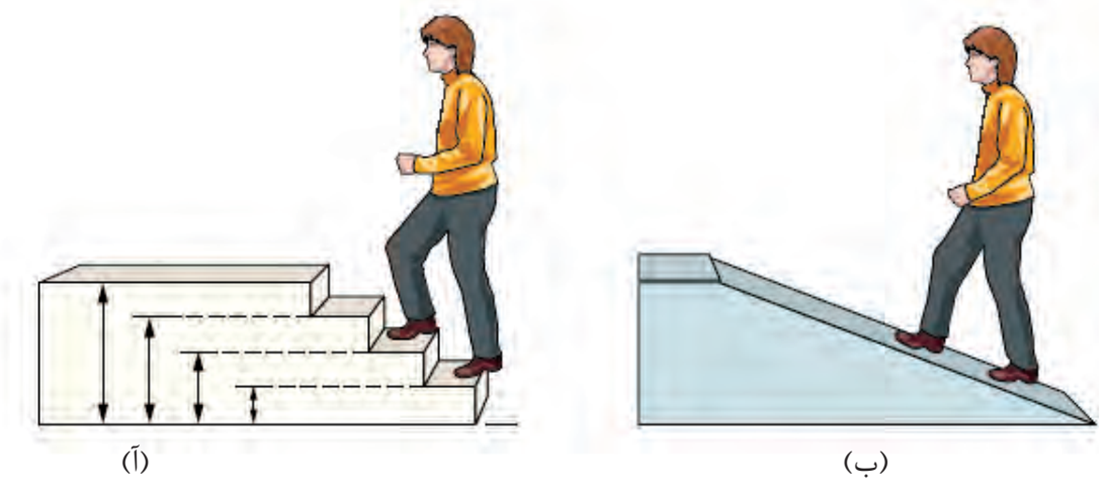
الکترون ها در هر لایه، انرژی و آرایش معینی دارند و معمولاً در پایین ترین و پایدار ترین لایه های ممکن قرار می گیرند. در این حالت اتم از پایداری نسبی برخوردار بوده و در حالت پایه قرار دارد
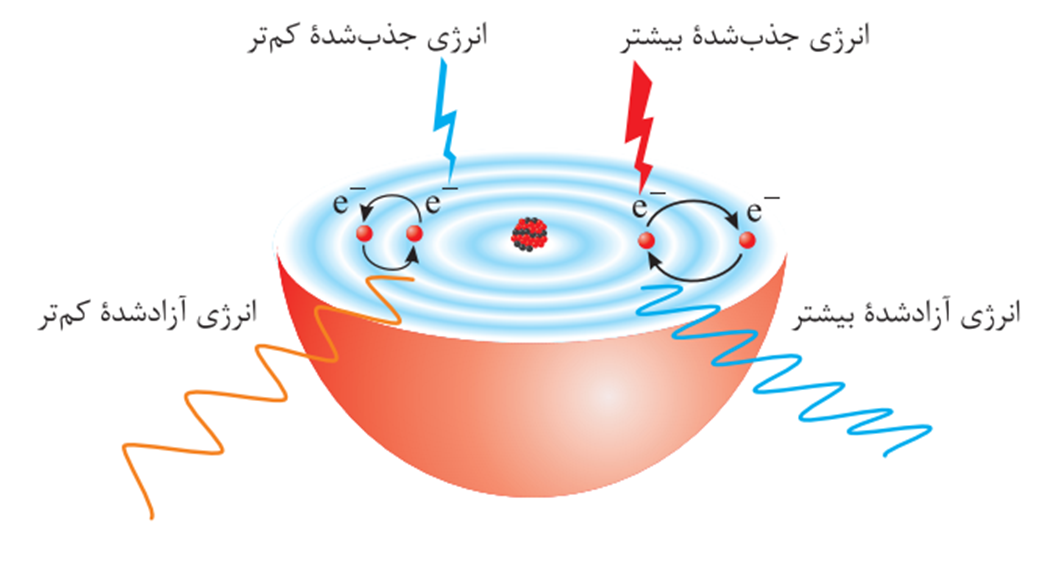
اگر به اتم ها در حالت پایه انرژی داده شود، الکترون های آنها با جذب انرژی به لایه های بالاتر منتقل می شوند. به اتم ها در چنین حالتی، اتم های برانگیخته می گویند
با توجه به اینکه اتم های برانگیخته پرانرژی و نا پایدارند، الکترون ها در آنها تمایل دارند به حالت پایه و اولیه بازگردند و پایدار شوند. هنگام بازگشت الکترون ها از لایه های بالاتر به لایه های پایین تر، الکترون ها انرژی اضافه خود را به صورت نور منتشر می کنند. این نور ها به صورت خطوط با نوارهای رنگی در طیف نشری خطی اتم ها دیده می شود.
از آنجا که انرژی لایه های الکترونی پیرامون هسته هر اتم ویژه همان اتم بوده و به عدد اتمی آن وابسته است، انرژی لایه ها و تفاوت انرژی میان آنها در اتم عنصرهای گوناگون متفاوت است؛ بنابراین انتظار می رود هر عنصر، طیف نشری خطی منحصر به فردی ایجاد کند.
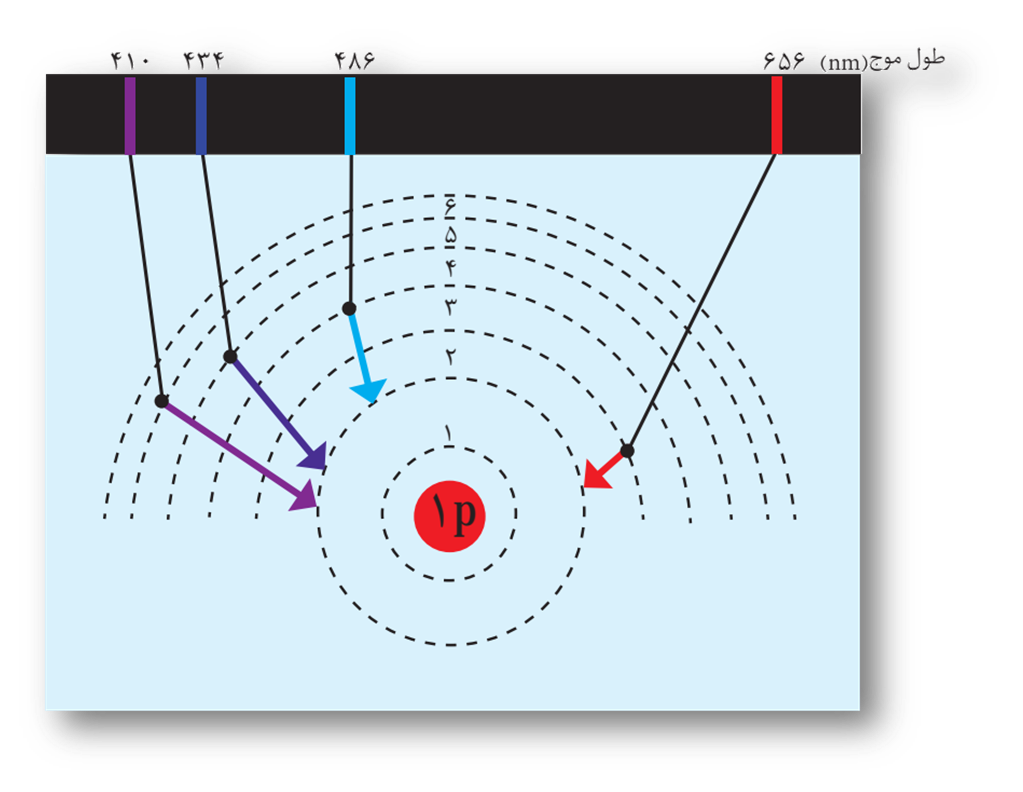
🟤طیف نشری خطی اتم هیدروژن🟤
در اتم هیدروژن، هرچه الکترون ها از لایه بالاتری به لایه ی پایین تر منتقل شوند، طول موج پرتو گسیل شده کمتر بوده و انرژی آن بیشتر خواهد بود.
در اتم هیدروژن، در اثر بازگشت الکترون از لایه 3 به 2 یک پرتو قرمز و در اثر بازگشت الکترون از لایه 4 به 2 یک پرتو سبز و در اثر بازگشت الکترون از لایه 5 به 2یک پرتو آبی و در اثر بازگشت الکترون از لایه 6به 2 یک پرتو بنفش گسیل می شود.


🟧🟧در ادامه تست هایی از این مبحث را بررسی میکنیم.🟧🟧












