توجه:
شما با مطالعه این درسنامه می توانید به سوالات 641-660 و 721-740 از کتاب نوروز و سوالات 107،108،275،277،445،446،447،617،771،774،923،926،929،1080،1083،1236از کتاب زرد پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
 | رویا خواجوی رتبه 8 منطقه سه ، کنکور تجربی 1403 دانشجوی دندانپزشکی شهید بهشتی |
درسنامه شامل :
خلاصه مطالب و نکات
5 تست کنکور سال های اخیر
سوالات نهایی مربوطه
سوالات نهایی :
- ﺑﺎ ﺗﻮﺟﻪ ﺑﻪ واکنش زﯾﺮ که نوعی پاک کننده پودري را ﻧﺸﺎن می دﻫﺪ ﺑﻪ ﺳﻮاﻻت پاﺳﺦ دﻫﯿﺪ.
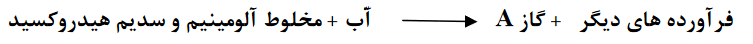
الف) نام گاز A را بنویسید .
ب) آیا این پاک کننده خورنده است؟
پ)تولید گاز چگونه قدرت پاک کنندگی این مخلوط را افزایش می دهد ؟ توضیح دهید .
- پی اچ محلول بازيBOHبرابر١٣است، غلظت يون هيدرونيوم و يون هيدروكسيدرا در اين محلول محاسبه كنيد.
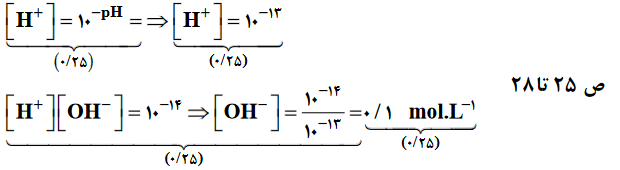
- محلولي ازباریم هیدروكسیدباغلظت01/0مول بر لیتردر دمای اتاق موجود است.
آ)غلظت یون هیدروکسید را در این محلول به دست آورید.
ب)شمار مول های یون هیدرونیوم در5/0لیتر این محلول را حساب كنید.
پ)pHمحلول رادر دمای اتاق به دست آورید.log5=0.7
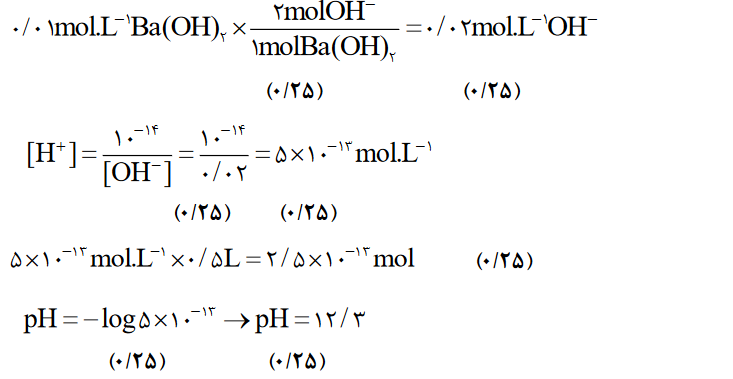
- اگر پی اچ باز ضعیف BOH برابر 12.4 باشد (log3=0.5)
الف) غلظت یون هیدروکسید را به دست آورید .
ب) محلول این باز با کدام ماده می تواند خنثی شود؟ (NaHCO3 یا CH3COOH)
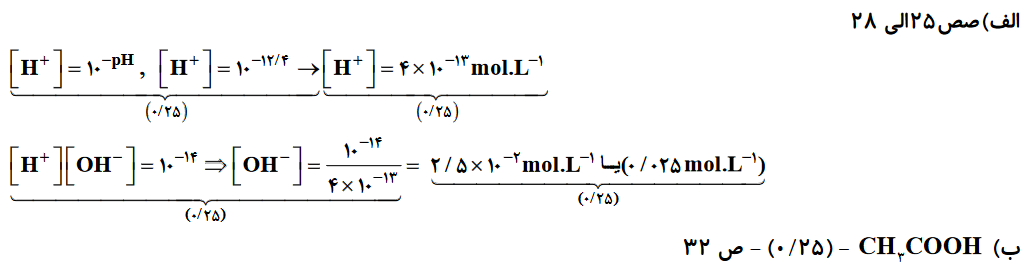
- در شیشه پاک کن ها از محلول ................. استفاده می شود .
آمونیاک
- در محلول آبی مواد بازی و pH محلول آنها در دمای اتاق در گستره 7 تا 14 خواهد بود. بدیهی است كه هر چه غلظت یون هیدروكسید در محلول آنها بیشتر باشد، PH بزرگتر و به 14 نزدیك تر است.
- بازها نیز همانند اسیدها ثابت یونش دارند كه آن را با kb نمایش می دهند. بدیهی است که در دمای معین هر چه Kb بزرگتر باشد آن باز قوی تر است .
- باز های قوی به طور کامل در ب آب آب تفکیک می شوند و درجه یونش آنها برابر 1 است .
- کلیه هیدروکسید های فلزات گروه اول جدول باز های قوی هستند هیدروکسید های گروه دوماز کلسیم به بعد باز قوی هستند .
- باز های قوی مواد خورنده به شمار می روند .
- آمونیاك از جمله بازهای ضعیف است. به طوری كه در محلول آن افزون بر مقدار كمی از یون های آب پوشیده، شمار بسیاری از مولكول های آمونیاك نیز یافت می شود .

آمونیاک(شیشه پاک کن) سدیم هیدروکسید(لوله بازکن)
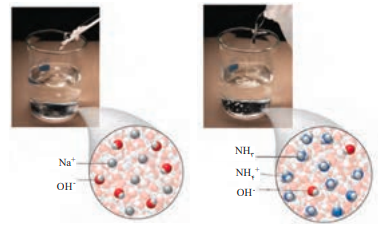
- آمین ها همانند آمونیاک باز هایی ضعیفبه شمار می روند .
- پی اچ محلول یک مولار یک باز قوی لزوما 14 نیست ، برای مثال اگر باز چند ظرفیتی باشد پی اچ آن بیشتر از 14 خواهد بود .
- محلول غلیظ سدیم هیدروکسید به عنوان لوله باز کن مورد استفاده قرار می گیرد .

واکنش بین اسید و باز
- یون های هیدرونیوم در واكنش با یون های هیدروكسید به مولكول های آب تبدیل می شوند در حالی كه یون های سدیم و کلرید دست نخورده باقی می مانند.
- واكنش خنثی شدن :
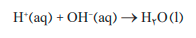
- این واكنش مبنایی برای كاربرد شوینده ها و پا ك كننده هاست.
- در واکنش خنثی شدن اسید و باز :
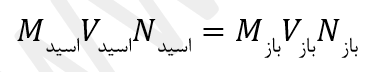
- (M غلظت ، N ظرفیت اسید یا باز ، V حجم محلول )
- برای باز کردن لوله ای که با مخلوطی از اسید های چرب مسدود شده است از محلول غلیظ سدیم هیدروکسید استفاده می شود . فراورده چنین واكنش هایی، خود نوعی پاک كننده است كه در آب حل می شود و می تواند چربی های اضافی را بزداید. باید از محلول غلیظ سدیم هیدروکسید استفاده کرد معادله واکنش هایی که انجام می شود
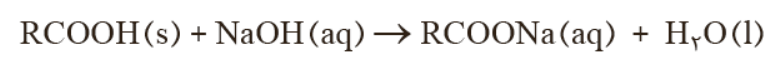
- اگر موادی که سبب گرفتگی لوله ها و مجاری می شوند خاصیت بازی داشته باشند برای باز کردن آنها از محلول غلیظ هیدروکلریک اسید استفاده می شود . لوله بازكن در واكنش با این رسوب ها، فراورده های محلول در آب یا گازی تولید میکند و از این راه سبب جرم گیری در آنها می شوند.
- برای زدودن باز ها ، اکسید ها یا نمک هایی مثل Fe(OH3) ، Fe2O3 ، CaCO3 از شوینده های اسیدی استفاده می شود و چون به خوبی با آنها واکنش می دهند و برای زدودن اسید های چرب و استر های سه عاملی بلند زنجیر از باز هایی مثل NaOH استفاده می شود . (اگر موادی که باعث مسدود شدن مسیر لوله ها شده اند بازی باشد از شوینده های اسیدی استفاده می شود و بالعکس)
- اگر در یک محلول 2 اسید وجود داشته باشد واکنش میان آنها به سمتی می رود که اسید ضعیف تر تولید شود .

- خوردن غذا سبب می شود كه غده های موجود در دیواره معده، هیدروكلریك اسید ترشح كنند. در بدن انسان بالغ روزانه بین دو تا سه لیتر شیره معده تولید می شود كه غلظت یون هیدرونیوم آن حدودا 0.03 مولار است .
- دیواره داخلی معده به طور طبیعی مقداركمی از یون های هیدرونیوم را دوباره جذب میکند. این جذب سبب نابودی سلول های سازنده دیواره معده می شود. حال اگر مقدار اسید معده به هر دلیل بیش از اندازه باشد، شمار یون های جذب شده افزایش یافته و سبب درد، التهاب و گاهی خونریزی معده می شود. مصرف غذاها و داروهای اسیدی سبب تشدید بیماری های معده خواهد شد. ضداسید ها داروهایی هستند كه برای این مورد تجویز می شوند.
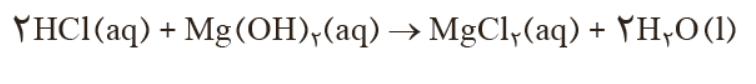
- در واقع درون معده یك محیط بسیار اسیدی است و حتی می تواند فلز روی را در خود حل كند البته با توجه به پتانسیل کاهشی که در درس بعد با آن آشنا می شوید نمی تواند فلز هایی مانندمس ، نقره ، پلاتین و طلا را در خود حل کند .
- مواد موثر در ضد اسید های مختلف :
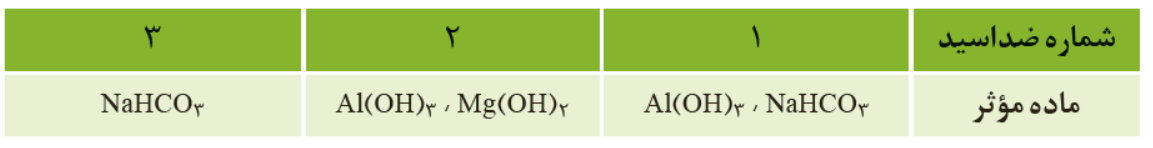
- برخی نمک ها خنثی نیستند و محلول آنها خاصیت اسیدی و بازی دارند صابون و جوش شیرین دارای خاصیت بازی اند ، از انجایی که از جوش شیرین به عنوان ضد اسید استفاده می شود .
- جوش شیرین که یک نمک بازی است درست مثل یک باز می تواند با اسید های چرب یا چربی واکنش دهد و آنها را به صابون تبدیل کند .

- مصرف مناسب مواد شوینده و پا ك كننده در پیشگیری از بیماری ها مؤثر است. همچنین مصرف درست و به موقع داروها سبب درمان بیماری ها می شود.این توصیف نشان می دهد كه نوع و میزان ارائه خدمات بهداشتی، دارویی و درمانی نقش تعیین كننده ای در سطح سلامت جامعه دارد.
- برای مشاهده حل ویدیویی تست ها کلیک کنید .
- 🌹برای عضویت در کانال کانون برتر ها کلیک کنید🌹


