سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات مباحث صفحه ی 44 تا 64 شیمی 3 مطابق با بودجه بندی آزمون 2 دی که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل دوم در کنکور سال های اخیر
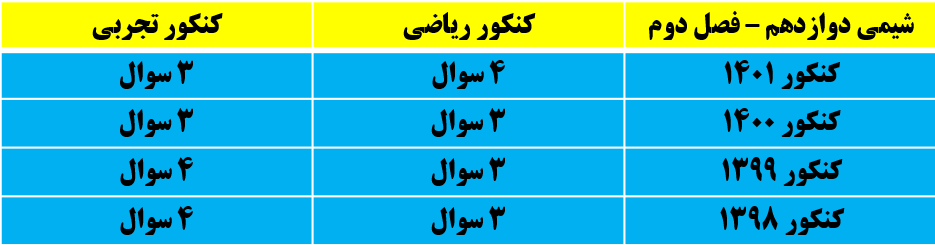
سلول گالوانی
اگر به جای داد و ستد الکترون بین واکنش دهنده ها، بتوان الکترون ها را از طریق یک مدار بیرونی هدایت و جابه جا کرد، می توان بخشی از انرژی در واکنش اکسایش _ کاهش را به انرژی الکتریکی تبدیل کرد.
به مجموعه ای که شامل یک تیغه ی فلزیM (الکترود) در محلولی از کاتیون های M^(n+) (محلول الکترولیت) قرار داده شده است، نیم سلول می گویند.
نکته: در نیم سلول، یک رسانای الکترونی(تیغه ی فلزی) در تماس با یک رسانای یونی (محلول الکترولیت) قرار دارد.
نکته: اگر در یک نیم سلول، غلظت کاتیون در محلول الکترولیت M (یک مول بر لیتر) باشد، نیم سلول استاندارد نامیده می شود.
در نیم سلول هایی که واکنش دهنده ی گازی دارند، نیم سلول استاندارد به حالتی گفته می شود که غلظت الکترولیت 1M) و فشار گاز (1atm) باشد.
از اتصال دو نیم سلول مطابق شکل روبرو، الکترولیت های آن ها توسطیک دیواره ی متخلخل از هم جدا شده اند، یک سلول گالوانی تشکیل می شود. در یکی زا نیم سلول ها نی مواکنش اکسایش و درنیم سلول دیگر نیم واکنش کاهش انجام می شود.
دیواره ی متخلخل امکان جابه جایی یون ها از یک سلول به نیم سلول دیگر را فارهم میکند تا محلول های الکترولیت حالت خنثی خود را حفظ کنند، ولی از مخلوط شدن سریع و مستقیم دو الکترولیت جلوگیری می کند.
توصیحات سلول گالوانی
سلول گالوانی نوعی سلول الکتروشیمیایی است که انرژی شیمیایی را به انرژی الکتریکی تبدیل می کند. در این نوع سلول ها:
1- الکترودی که نیم واکنش اکسایش در آن صورت می گیرد، آند نامیده می شود.
2- الکترودی که نیم واکنش کاهش در آن صورت می گیرد، کاتد نامیده می شود.
3- جهت حرکت الکترون ها در مدار بیرونی از آند به کاتد است.
4- کاتد قطب مثبت و آند قطب منفی سلول است.
5- الکترولیت های دو نیم سلول توسط یک دیواره ی متخلخل از یکدیگر جدا شده اند.
6- از طریق دیواره ی متخلخل کاتیون ها به سمت کاتد و آنیون ها به سمت آند حرکت می کنند تا حالت خنثی در هر دو نیم سلول حفظ شود.
7- فلز فعال تر آند است.
به عنوان مثال، سلول گالوانی استاندارد روی _ مس شامل نیم سلول استاندارد روی(تیغه ی روی در محلول 1M, ZnSO_4) و نیم سلول استاندارد مس (تیغه ی مس در محلول 1M, CuSO4) است که محلول دو الکترولیت توسط یک دیواره ی متخلخل از هم جدا شده اند.
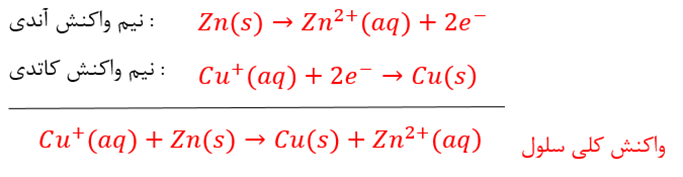
توجه: در این واکنش به ازای هر مول فلز 2 مول الکترون مبادله می شود.
در نتیجه ی نیم واکنش اکسایش، تیغه ی آند Zn به تدریج حل شده و کاهش جرم می یابد. از طرفی انتظار می رود غلظت کاتیون روی از آنیون ها بیشتر شود، اما در عمل این اتفاق نمی افتد.
در نتیجه ی نیم واکنش کاهش، تیغه ی کاتد Cu به تدریج افزایش جرم می یابد. از طرفی انتطار می رود غلظت آنیون ها از کاتیون مس بیشتر شود اما در عمل این اتفاق نمی افتد.
دلیل تغییر نکردن غلظت یون ها در محلول آندی و کاتدی این است که کاتیون از نیم سلول آند به کاتد و آنیون ها از نیم سلول کاتد به آند با گذر از دیواره متخلخل مهاجرت می کنند.

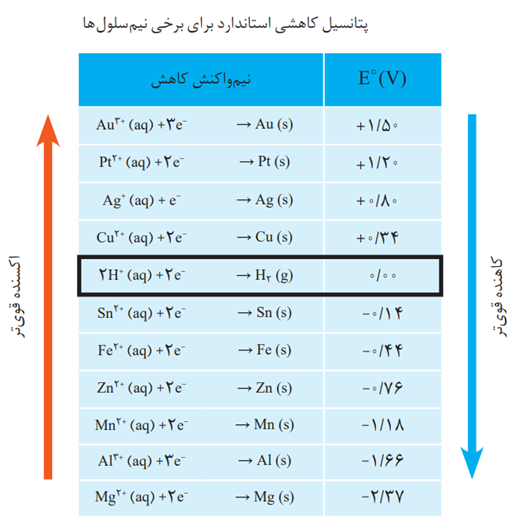
در سری الکتروشیمایی:
نیم واکنش ها به صورت کاهشی نوشته شده و پتانسیل داده شده، تمایل برای کاهش یا قدرت اکسندگی گونه ی سمت چپ در نیم واکنش را نشان می دهد.
این سری دارای نکات زیر است:
1- از بالا به پایین پتانسیل کاهشی کوچکتر می شود.
2- هر چه گونه ای بالاتر باشد، E^° بزرگتری دارد پس تمایل برای کاهش بیشتر است و اکسنده ی قوی تری است.
3- هر چه گونه ای پایین تر باشد، E^° کمتری دارد پس اکسنده ضعیف تری است. البته در این حالت گونه ی کاهنده که در سمت راست نیم واکنش نوشته شود، قوی تر است.
4- پتانیسل کاهشی هیدروژن برابر صفر است.
5- پتانسیل کاهشی گونه های بالای هیدروژن مثبت است.
6- پتانسیل کاهشی گونه های پایین هیدروژن منفی است.
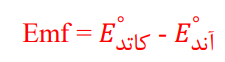
ویژگی های سلول سوختی
1- نوعی سلول گالوانی است که می تواند انرژی شیمیایی واکنش اکسایش _ کاهش مربوط به سوختن گازی را به انرژی الکتریکی تبدیل کند.
2- کارایی بیشتری از موتورهای درون سوز دارد. مثلا سوزاندن هیدروژن در یک موتور درون سوز، بازدهی حدود 20 درصد دارد، در حالی که اکسایش هیدروژن در سلول سوختی بازده را تا 3 برابر (حدود 60 درصد) افزایش می دهد.
3- دوستدار محیط زیست و منبع انرژی سبز به شمار می آید و ردپای کربن دی اکسید را کاهش می دهد.
تبدیل انرژی شیمیایی موجود در یک سوخت به انرژی الکتریکی قابل استفاده در یک نیروگاه حرارتی، شامل 5 مرحله ی زیر است:
تبدیل انرژی شیمیایی موجود در یک سوخت به انرژی الکتریکی قابل استفاده در یک سلول سوختی، شامل 2 مرحله است:
نکته: تبدیل انرژی سوخت های فسیلی مانند متان به انرژی الکتریکی از طریق سوزاندن، با بازده کمی صورت می گیرد.
زیرا بخش عمده ای از انرژی به صورت گرما به محیط اطراف داده می شود و به انرژی الکتریکی تبدیل نمی شوند.
هر سلول سوختی سه جز اصلی دارد:
1) الکترود آند 2) الکترود کاتد 3) یک غشاء
شکل زیر، رایج ترین سلول سوختی، یعنی سلول سوختی هیدروژن – اکسیژن را نشان می دهد.
عدد اکسایش
عدد اکسایش یک اتم در ترکیب برابر با تعداد بارهای مثبت یا منفی است که به آن اتم نسبت داده می شود.
نکات مهم برای بدست آوردن عدد اکسایش:
1- عدد اکسایش یک یون تک اتمی برابر بار یون است. مانند Na+ که برابر 1+ است.
2- عدد اکسایش عنصر به حالت آزاد صفر است. (Fe,O2,Cu,H2)
3- عدد اکسایش هیدروژن در ترکیب ها 1+ است بجز در هیدرید های فلزی (AlH3,CaH2, NaH)
4- عدد اکسایش اکسیژن در ترکیب ها 2- است، بجز در OF2 که 2+ و در پراکسیدها مانند (Na2O2,H2O2) که 1- است.
5- مجموع عدد اکسایش اتم های سازنده یک مولکول برابر صفر است.
6- مجموع عدد اکسایش اتم های سازنده ی یک یون چند اتمی برابر بار یون است.
7- عدد اکسایش فلزهای قلیایی در ترکیب ها 1+ و قلیایی خاکی 2+ است.
8- عدد اکسایش می تواند برای یک اتم در ترکیبات گوناگون متفاوت باشد.

فرایند هال:
آلومینیم کاهنده تر از آهن است و سریع تر اکسید می شود. اما آلومینیوم برخلاف آن خورده نمی شود.
آلومینیم در طبیعت مانند دیگر فلزهای فعال به حالت آزاد وجود ندارد و به شکل ترکیب یافت می شود. به همین دلیل این فلز تنها از برقکافت نمک های مذاب آن به دست می آید.
برقکافت Al2 O3 ناخالص است. برقکافت Al2 O3 در یک سلول الکترولیتی تهیه می کنند.

ساده – آزمون کانون قلم چی 1400

متوسط – آزمون کانون قلم چی 1400

سخت – آزمون کانون قلم چی 1400

متوسط - آزمون کانون قلم چی 1400

سخت - آزمون کانون قلم چی 1400
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید.
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام و تلگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی





