سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات مباحث صفحه ی 28 تا 44 شیمی 3 مطابق با بودجه بندی آزمون 3 آذر که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
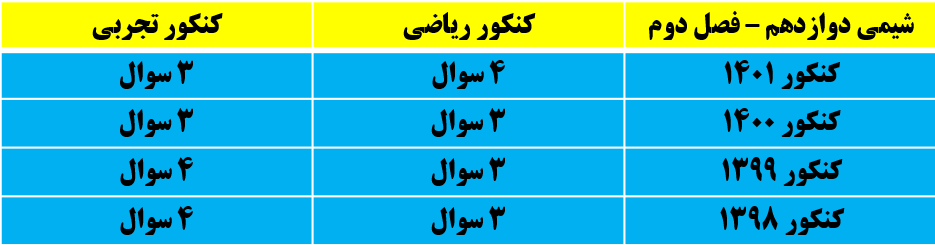
بودجه بندی فصل دوم در کنکور سال های اخیر
الکتروشیمی
مبنای تولید انرژی الکتریکی در الکتروشیمی، واکنش هایی هسند که با داد و ستد الکترون همراه هستند.
دو رکن اساسی فناوری های پیشرفته برای افزایش سطح رفاه و آسایش جامعه به صورت زیر هستند:
1- دستیابی به مواد مناسب 2- تامین انرژی
الکتروشیمی شاخه ای از علم شیمی می باشد که موجب بهبود خواص مواد و تامین انرژی می گردد.

واکنش هایی که با مبادله ی الکترون بین گونه های واکنش دهنده همراه باشد را واکنش های اکسایش و کاهش می نامند.
اکسایش به معنی از دست دادن الکترون و کاهش به معنای گرفتن الکترون می باشد.
اکسیژن نافلزی فعال است که با اغلب فلزها واکنش می دهد و آن ها را به اکسید فلز تبدیل می کند. در حالی که با برخی فلزها مانند طلا و پلاتین واکنش نمی دهد. واکنش اکسیژن با فلزات نمونه ای از واکنش های اکسایش – کاهش است.
مرور اکسایش و کاهش
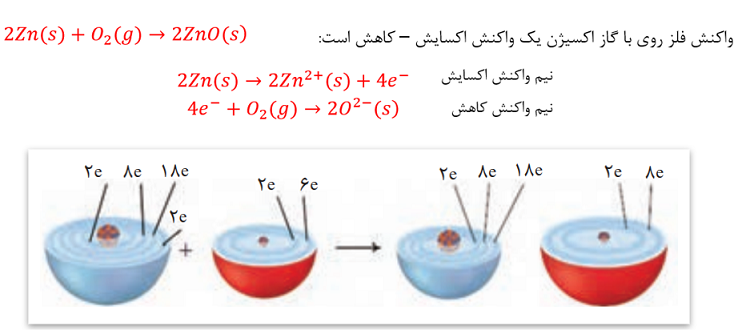
در این واکنش روی الکترون از دست داده و اکسایش یافته در حالی که گاز اکسیژن الکترون گرفته و کاهش یافته است.
هر یک از فرآیندهای گرفتن و از دست دادن الکترون با یک نیم واکنش نشان داده می شود. بنابراین هر واکنش اکسایش – کاهش شامل دو نیم واکنش (نیم واکنش اکسایش و نیم واکنش کاهش است).
گونه ای که الکترون از دست می دهد و اکسایش می یابد سبب کاهش گونه های دیگر می شود، بنابراین کاهنده نامیده می شود.
الکترون دهنده = اکسایش یابنده = کاهنده
گونه ای که الکترون می گیرد و کاهش می یابد سبب اکسایش گونه ی دیگر می شود. بنایراین اکسنده نامیده میشود.
الکترون گیرنده = کاهش یابنده = اکسنده
نکته: اغلب فلزها در واکنش با نافلزها تمایل دارند اکسایش یابند و به کاتیون تبدیل شوند. نافلزها نیز تمایل به کاهش دارند و به آنیون تبدیل می شوند. بنابراین فلزها اغلب کاهنده و نافلزها اغلب اکسنده هستند.
نکته: به طور کلی هر چه فلز کاهنده ی قوی تری باشد، کاتیون آن اکسنده ی ضعیف تری است.
نکته: در واکنش روی با محلول مس (II) سولفات 2 مول الکترون مبادله می شود و فرآورده ها از واکنش دهنده ها پایدارترند.

ساده – آزمون کانون قلم چی 1400


متوسط – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400


متوسط - آزمون کانون قلم چی 1400


سخت - آزمون کانون قلم چی 1400


دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید.
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام و تلگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی





