توجه:
شما با مطالعه این درسنامه می توانید به سوالات 76-90 و 196-210از کتاب نوروز دوازدهم و سوالات 83،97،264،432،435،597،602،759،762،911،913،915،939،1061،1070،1222از کتاب زرد دوازدهم پاسخ دهید.
برای خرید کتاب ها به سایت کانون بوک مراجعه کنید.
سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات مباحث صفحه ی 1 تا 14 شیمی 2 مطابق با بودجه بندی آزمون 22 مهر که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل اول در کنکور سال های اخیر
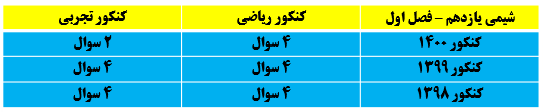
دسته بندی عنصر ها و ویژگی های هر دسته
علم شیمی را می توان مطالعه ی هدفدار، منظم و هوشمندانه رفتار عنصرها و مواد، برای یافتن روندها و الگوی رفتار فیزیکی و شیمیایی آن ها دانست.
همانطور که می دانید بنیادی ترین ویژگی عنصرها عدد اتمی Z است و عناصر در جدول دوره ای بر اساس افزایش عدد اتمی چیده شده اند. در این جدول عنصرهایی که تعداد الکترون های بیرونی ترین لایه آن ها یکسان است، هم گروه هستند به جز He در گروه گاز های نجیب. عناصر هم دوره دارای تعداد الکترون های برابری می باشند.
با بررسی رفتار و خواص عناصر می توان عناصر جدول دوره ای را به 3 دسته تقسیم کرد:
1- فلز ها
بیش تر عناصر جدول دوره ای را تشکیل می دهند که دارای خواص زیر می باشند:
-به طور عمده در سمت چپ و مرکز جدول قرار دارند.
- اغلب دارای سطح براق و صیقلی هستند.
- اغلب جامد هایی شکل پذیر هستند.
-در واکنش با دیگر عنصر ها الکترون از دست می دهند.
-در اثر ضربه تغییر شکل می دهند اما خرد نمی شوند (قابلیت چکش خواری، شکل پذیری)
-مانند Na, Mg, Al, Sn, Pb
نکته: همه ی فلزات جدول جامد و تک اتمی هستند به جز جیوه (Hg) که تنها فلز مایع است.
2- نافلز ها:
به طور عمده در سمت راست و بالای جدول دوره ای قرار دارند.
در واکنش با دیگر اتم ها، الکترون به اشتراک می گذارند یا می گیرند.
سطح آن ها در حالت جامد درخشان نبوده و کدر هستند.
جریان برق و گرما را عبور نمی دهند، به جز کربن که رسانای الکتریسیته است.
در حالت جامد در اثر ضربه خرد می شوند. (شکننده)
مانند کربن C6, فسفر P15 ,گوگرد S16 ,کلر Cl17
3- شبه فلز ها:
عناصری هستند که همانند مرزی بین فلز ها و نافلزها قرار دارند.
خواص فیزیکی آن ها بیش تر به فلزها شبیه است در حالی که رفتار شیمیایی آن ها همانند نافلزهاست.
اغلب رسانایی الکتریک کمی دارند(نیمه رسانا)
در واکنش با دیگر اتم ها الکترون به اشتراک می گذارند.
معمولا شکننده هستند و بر اثر ضربه خرد می شوند. Si14, 32Ge

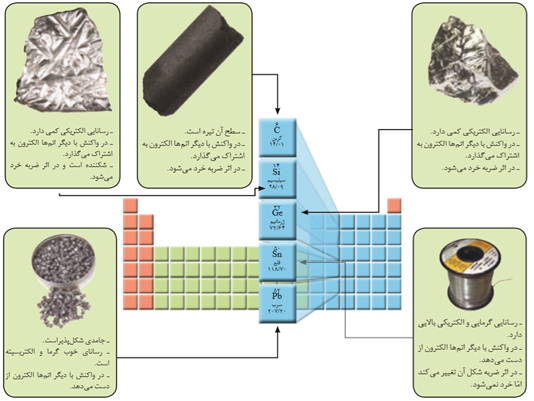
تمام عنصر های دسته ی S به جز(H و He)، تمام عنصر های دسته ی d , f و برخی از عناصر دسته p فلزند.
در بین عنصر های دسته p، فلز، نافلز و شبه فلز وجود دارد.
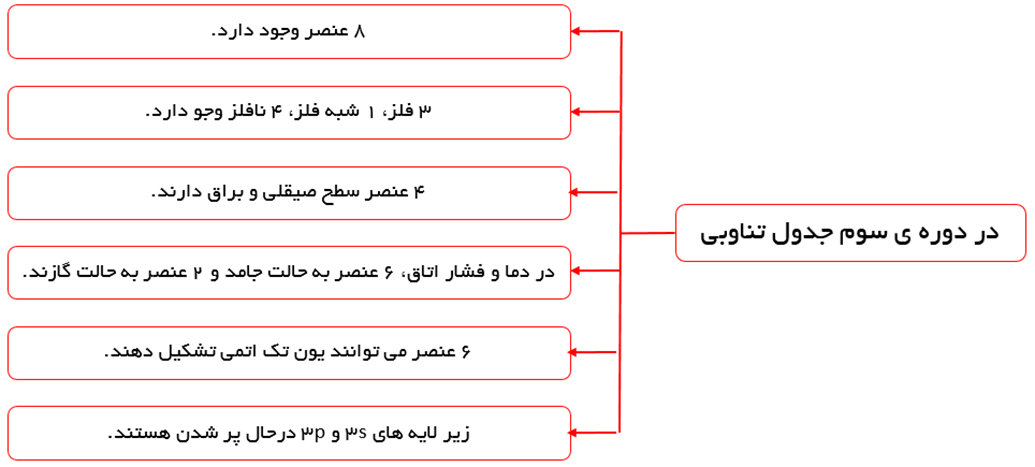
عناصر دوره ی سوم
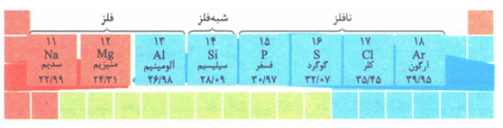
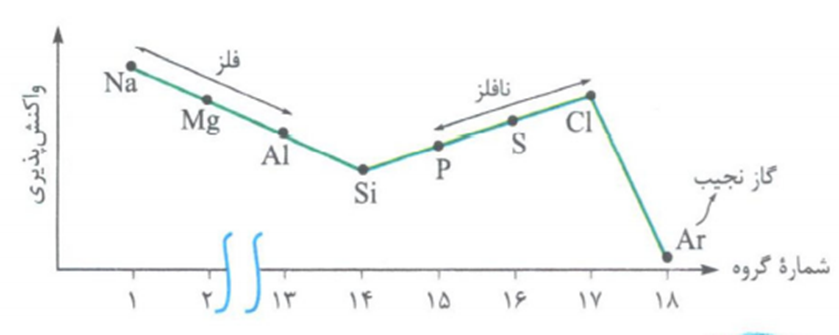
خصلت فلزی و نافلزی
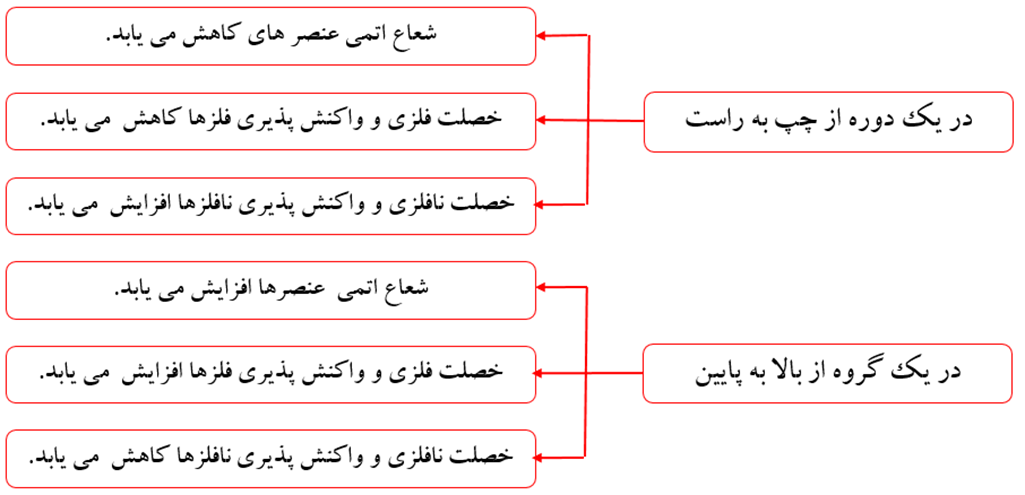
خصلت فلزی به معنای ویژگی های فیزیکی و شیمیایی مربوط به فلز می باشد که در یک گروه از بالا به پایین، افزایش می یابد.
توجه: هر چه یک فلز، تمایل بیش تری به از دست دادن الکترون های ظرفیتی خود داشته باشد، واکنش پذیری و خصلت فلزی آن بیش تر است. به عنوان مثال: Fr > Cs > Rb > K > Na > Li : خصلت فلزی
خصلت نافلزی به معنای ویژگی های فیزیکی و شیمیایی مرتبط به نافلزها می باشد که در یک گروه از بالا به پایین، کاهش می یابد.
توجه: هر چه یک نافلز، تمایل بیش تری برای گرفتن الکترون داشته باشد، واکنش پذیری و خصلت نافلزی بیش تری دارد.
به عنوان مثال: F > Cl > Br > I > At خصلت نافلزی
نکته: خصلت فلزی در یک دوره از چپ به راست، کاهش و خصلت نافلزی در یک دوره از چپ به راست، افزایش می یابد.
نکته: به طور کلی: در بین عناصر جدول دوره ای، فرانسیم فعال ترین فلز و فلوئور فعال ترین نافلز می باشند.
توجه: جدول پیشنهادی ژانت مطابق با مدل کوانتومی است و در دو ردیف جدید این جدول زیر لایه (g) به عنوان زیر لایه ی پنجم پس از s , p , d , f پر می شود. در ضمن زیرلایه ی g با (I=4) حداکثر گنجایش 18 الکترون را دارد.
شعاع اتمی
به طور کلی هر چه شعاع یک اتم بزرگتر باشد، اندازه آن اتم نیز، بزرگتر است.
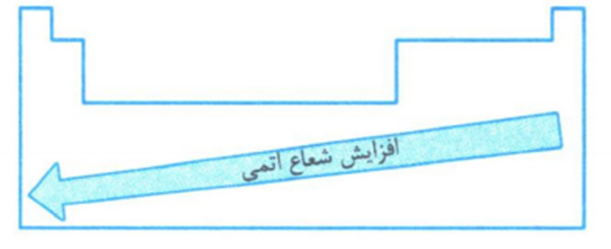
به طورکلی، شعاع اتمی عنصرهای جدول دوره ای در یک گروه از بالا به پایین افزایش می یابد؛ زیرا تعداد لایه های الکترونی بیش تر می شود.
به طور کلی در یک دوره شعاع اتمی از چپ به راست کاهش می یابد؛ زیرا در یک دوره تعداد لایه های الکترونی ثابت می ماند؛ در حالی که تعداد پروتون های هسته بر الکترون ها بیش تر شده و شعاع اتم کاهش می یابد.
در بین تمام عناصر جدول دوره ای، عنصر Fr دارای بیش ترین و عنصر H دارای کم ترین شعاع اتمی است.
توجه: از آن جا که عنصر Fr بسیار کمیاب است، می توان شعاع Cs رابه عنوان بیش ترین شعاع اتمی در نظر گرفت.
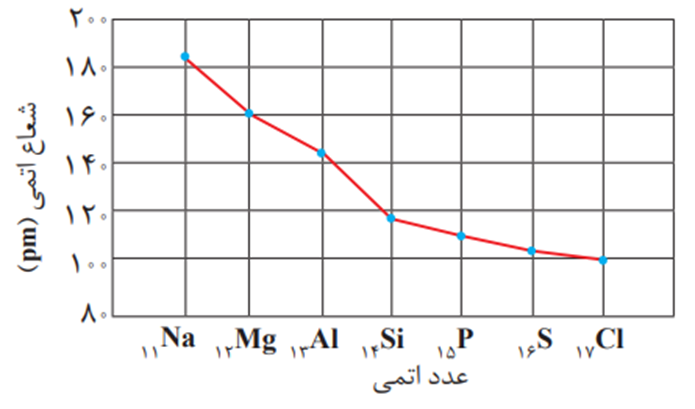
در این دوره بیشترین تفاوت شعاع اتمی دو عنصر متوالی به Si , Al مربوط است.
با توجه به نمودار می توان فهمید که شیب تغییرات شعاع در ابتدا (سمت چپ) تناوب بیش تر از شیب آن ها در انتها (سمت راست) تناوب است که این موضوع به دلیل افزایش دافعه بین الکترون ها در عناصر انتهایی تناوب می باشد.
با توجه به روند تغییر شعاع اتمی در یک گروه و دوره، هر چه عنصری در جدول دوره ای، سمت چپ تر و پایین تر، شعاع آن بزرگتر است و بالعکس.
رابطه خصلت فلزی و نافلزی با شعاع اتم ها
هر چه شعاع اتم بزرگتر باشد، اتم آسان تر الکترون از دست می دهد و خصلت فلزی افزایش می یابد.
خصلت فلزی عناصر گروه اول از عناصر هم دوره گروه دوم بیش تر است که این موضوع به دلیل کم تر بودن تعداد الکترون ظرفیت عناصر گروه اول (1 الکترون) نسبت به تعداد الکترون های لایه ظرفیت گروه دوم (2 الکترون) می باشد.
به طور کلی هر چه شعاع اتمی کوچک تر می شود، اتم آسان تر الکترون می گیرد، بنابراین دلیل اینکه خصلت نافلزی در یک گروه از بالا به پایین کاهش می یابد، افزایش شعاع اتم می باشد.

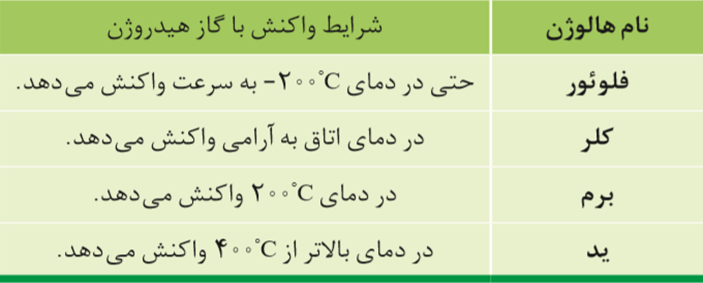

ساده – آزمون کانون قلم چی 1400


متوسط – آزمون کانون قلم چی 1400


سخت – آزمون کانون قلم چی 1400


متوسط - آزمون کانون قلم چی 1400
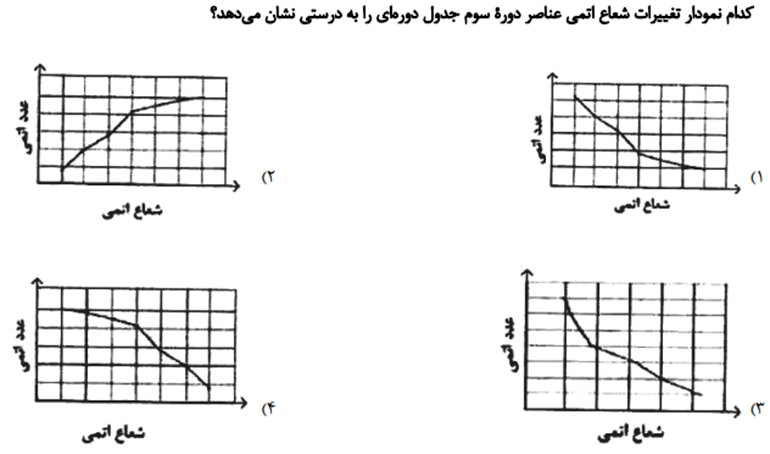

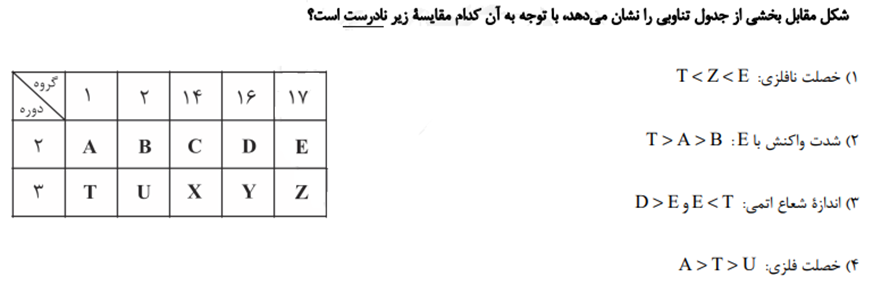
متوسط - آزمون کانون قلم چی 1400

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید.
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم؛ برای ارتباط با رتبه برترها صفحه اینستاگرام و تلگرام زیر رو دنبال کنید.
با آرزوی موفقیت و کامیابی





