*(بچه ها دقت کنید که درسنامه کامل این مبحث در انتهای مطلب ضمیمه شده)*
توزیع الکترون ها در لایه ها و زیر لایه ها:
عنصر ها در جدول اتمی بر مبنای عدد اتمی چیده شده اند و اتم هر عنصر نسبت به اتم عنصر پیشین یک الکترون بیش تر دارد. از سویی ساختار لایه ای اتم باعث شده است که میان شمار عنصر های موجود در هر دوره و گنجایش لایه های الکترونی رابطه ویژه ای بر قرار باشد. به توالی روبرو دقت کنید: از این توالی در می یابیم که حداکثر میزان الکترون در یک لایه از رابطه e=2n2 بدست می آید.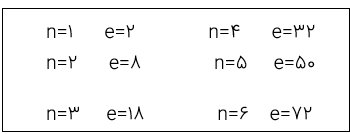
عدد کوانتومی فرعی چیه؟
هر لایه الکترونی خود از یک یا چند زیر لایه تشکیل شده است که برای مشخص کردن نوع زیر لایه ها از عدد کوانتومی فرعی استفاه میکنیم. عدد کوانتومی فرعی سطح انرژی الکترون یا زیر لایه را مشخص می کند.
نکته: حداکثر شمار الکترون هایی که در هر زیر لایه میتوانند جا بگیرند از رابطه زیر بدست می آید: e=4l+2
4نکته کوانتومی قشنگ!
نکته: در یک لایه الکترونی هیچ گاه مجموع n+l برای دو زیر لایه یکسان نیست.
نکته: در اغلب عناصر سطح انرژی هر زیر لایه هم بهn+l و هم بهnوابسته است هر چهn+l بیشتر باشد انرژی زیر لایه بیشتر است.
نکته: اگر n+l برای دو یا چند زیر لایه یکسان شد زیر لایه ای که n بزرگتری دارد انرژی زیر لایه بیشتری نیز دارد.
نکته: هرچه n+l در یک اتم کوچکتر باشد سطح انرژی پایین تر است و در نتیجه آن لایه زود تر از الکترون اشغال می شود.
آرایش الکترونی اتم
رفتار و ویژگی هر اتم را می توان از روی آرایش الکترونی آن توضیح داد.

در هر دسته چند عنصر وجود داره؟
دستهs: تنها شامل عناصر اصلی است و در هر 7 دوره جدول حضور دارند. در نتیجه دستهs دارای 14 عنصر است.
دستهp: شامل عناصر اصلی جدول از گروه 13 تا 18 به جز عنصر He است در نتیجه این دسته از عناصر به جز دوره اول در 6 دوره از جدول تناوبی حضور دارند و تعداد آنها 36 عنصر است.
دستهd: عناصر این دسته از دوره 4 شروع می شوند (از اسکاندیم عدد اتمی) و در چهار دوره آخر جدول تناوبی حضور دارند. این دسته شامل عناصر گروه 3تا12 هستند و کمترین عنصر در یک گروه متعلق به همین دسته است. در نتیجه این دسته دارای 40 عنصر است.
نکته ترکیبی: یادتون هست که وجود عناصر دسته d در ترکیبات رنگ های متنوع ایجاد می کرد مثل یاقوت که رنگ سرخ آن بدلیل وجود ترکیبات فلزات واسطه است.
دستهf: شامل 14 عنصر در دوره ششم و 14 عنصر در دره هفتم است در نتیجه این دسته دارای 28 عنصر از عناصر جدول تناوبی است.
ساختار لوییس

برای درک بهتر این مطلب بهتر است به ساختار لوییس های مهم که در صفحه انتهای جزوه آورده شده توجه کنید. امیدوارم که برای شما مفید واقع بشه :)
برای دیدن کامل این جزوه به فایل ضمیمه انتهای مطلب مراجعه کنید |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.




