به نام خدا
درسنامه شیمی یازدهم مطابق با دفترچه آزمون ۸ بهمن
پرهام علی پور، رتبه 96 منطقه 1 و دانشجوی دندانپزشکی دانشگاه تهران
فصل دوم: در پی غذای سالم
گرماشیمی شاخه ای از علم شیمی است که به بررسی واکنش ها و انرژی آزاد شده یا مورد نیاز آنها ، تفاوت گرما و دما ، مواد ، پیوند ها و ... با دیدگاه انرژی محور میپردازد.
تفاوت دما و گرما در آن است که دما میانگین انرژی جنبشی ذرات یک ماده میباشد و در واقع ما این عدد را به این جسم نسبت داده ایم در حالی که گرما انرژی آزاد شده و یا مصرف شده در طی یک واکنش است و ما این عدد را به یک واکنش نسبت داده ایم ، از دیگر تفاوت های این مورد این میباشد که گرما از جنس انرژی میباشد و با واحد های ژول ، کالری و ... بیان میشود در حالی که دما از جنس انرژی نمیباشد و واحد آن سلسیوس و کلوین و یا فارنهایت میباشد.
دما برای توصیف یک ماده و تغییر دما و گرما برای توصیف یک فرآیند بکار میروند.
هر چه دمای یک ماده بیشتر باشد میانگین تندی و میانگین انرژی جنبشی ذرات آن ماده بیشتر است.
به مجموع(و نه میانگین!) انرژی ذرات ماده انرژی گرمایی میگوییم و این کمیت هم به دما و هم به جرم ماده بستگی دارد.
یکای رایج دما ، درجه سلسیوس میباشد در حالی كه یكای دما در SIكلوین است.
نماد دما برحسب سلسیوس، θ و نماد دما برحسب كلوین ، T است.
ارزش دمایی یک درجه کلوین با یک درجه سلسیوس برابر میباشد.
روغن و چربی از جمله تركیب های آلی هستند كه به دلیل تفاوت در ساختار، رفتارهای فیزیكی و شیمیایی متفاوتی دارند. روغن دارای حالت فیزیكی مایع بوده اما چربی جامد است. از دیدگاه شیمیایی، در ساختار مولكول های روغن، پیوندهای دوگانه بیشتری وجود داشته و واكنش پذیری بیشتری نیز دارد.
ظرفیت گرمایی ماده(C) هم ارز با گرمای لازم برای افزایش دمای آن به اندازه یك درجه سلسیوس است.
ظرفیت گرمایی یك گرم ماده ، ظرفیت گرمایی ویژه یا گرمای ویژه ( c )آن ماده را نشان میدهد.
ظرفیت گرمایی در دما و فشار اتاق، افزون بر نوع ماده به مقدار آن نیز بستگی دارد. در حالی كه گرمای ویژه در این شرایط، تنها به نوع ماده وابسته است.
در یکسری از واکنش های شیمیایی گرما آزاد میشود که به آنها واکنش های گرماده میگوییم و در دسته ای دیگر سامانه از محیط گرما میگیرد و باعث سرد شدن محیط میشود که به آنها واکنش های گرماگیر میگوییم.
برای حساب كردن گرمای جذب یا آزاد شده در چنین فرایندهایی میتوان از رابطه θ∆mc = Q استفاده كرد.
اگرQ منفی باشد واکنش گرماده و اگرQ مثبت باشد واکنش گرماگیر است.
نمودار دو فرآیند گرماده متفاوت در مسیر خوردن و هضم و جذب شیر :
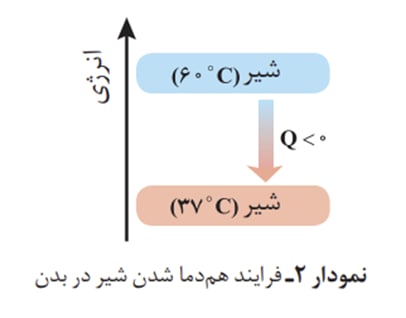
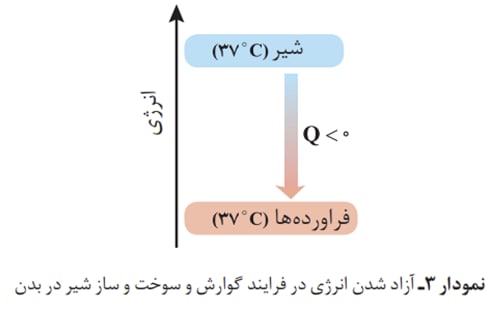
یكی از راه های آزادشدن انرژی مواد ، سوزاندن آنهاست. سوخت هایی مانند گاز شهری، بنزین، الكل و زغال هنگام سوختن انرژی آزاد می كنند و این انرژی برای گرم كردن خانه ، پخت و پز و نیز به حركت درآوردن خودروها مصرف میشود.
پژوهش ها نشان میدهد که این مقدار گرمای آزادشده ناشی از تفاوت انرژی گرمایی (مجموع انرژی جنبشی ذره ها) در مواد واکنش دهنده و فراورده نیست! زیرا در دمای ثابت، تفاوت چشمگیری میان انرژی گرمایی آنها وجود ندارد. شیمیدان ها گرمای جذب یا آزادشده در هر واکنش شیمیایی را به طور عمده وابسته به تفاوت میان انرژی پتانسیل مواد واکنش دهنده و فراورده میدانند. با این توصیف، انرژی پتانسیل یک نمونه ماده، انرژی نهفته شده در آن است، انرژی ای که ناشی از نیروهای نگهدارنده ذره های سازنده ی آن است.
با انجام یک واکنش شیمیایی و تغییر در شیوه اتصال اتم ها به یکدیگر، تفاوت آشکاری در انرژی پتانسیل وابسته به آنها ایجاد میشود ؛ تفاوت انرژی ای که در واکنش ها به شکل گرما ظاهر میشود.
در برخی منابع از انرژی پتانسیل موجود در یک نمونه ماده، با نام انرژی شیمیایی هم یاد میشود.
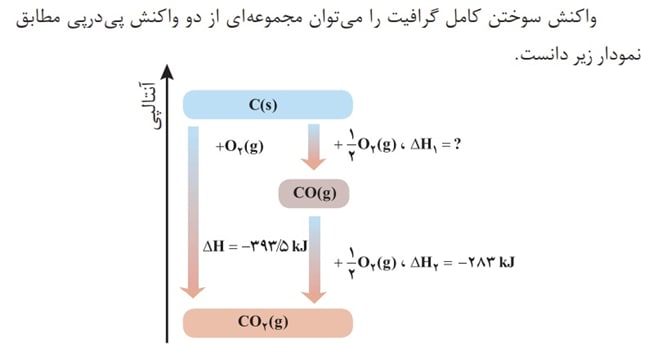
گرافیت و الماس دو آلوتروپ کربن هستند و گرافیت از الماس پایدار تر میباشد بنابر این موقع سوختن انرژی کمتری آزاد میکند.
تغییر حالت فیزیکی مواد :
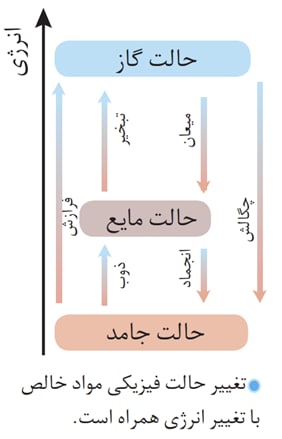
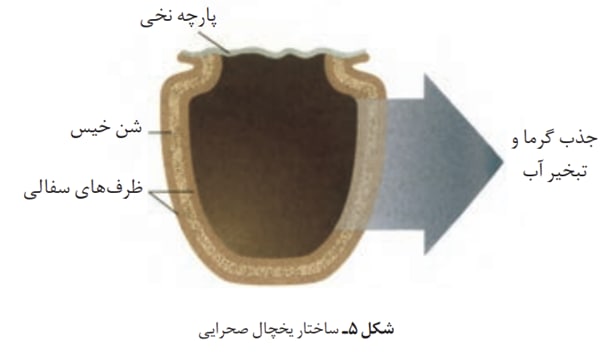
طریقه کار یخچال صحرایی به این صورت است که آبی که درون ظرف سفالی قرار دارد به درون منافذ سفال نفوذ میکند و به سطح کوزه میرسد و درآنجا به واسطه ی انرژی ای که از آب درون کوزه میکیرد تبخیر میشود و آب درون کوزه به علت از دست دادن این انرژی خنک میشود.
شیمیدان ها انرژی کل یک سامانه را را هم ارز با محتوای انرژی یا آنتالپی آن میدانند. با این توصیف هر سامانه در دما و فشار ثابت ، آنتالپی معینی دارد. بدیهی است که با انجام واکنش شیمیایی گرماگیر در یک سامانه ، مواد با محتوای انرژی (آنتالپی) کمتر به موادی با انرژی (آنتالپی)بیشتر تبدیل میشوند.
برای یک واکنش اغلب به جای تغییر آنتالپی واکنش ، واژه آنتالپی واکنش به کار میرود.
شیمیدان ها تغییر آنتالپی هر واكنش را هم ارز با گرمایی میدانند كه در فشار ثابت با محیط پیرامون دادوستد می كند و آنرا با Qp نشان میدهند. نماد آنتالپی ، »H »است در حالیکه نماد تغییر آنتالپی، »ΔH »میباشد ؛ کمیتی که با رابطه زیر بیان میشود:
Qp = مواد واکنشدهنده H ـ (مواد فراورده) H = (واکنش) H∆

بدست آوردن آنتالپی واکنش از راه تجربی و مستقیم :
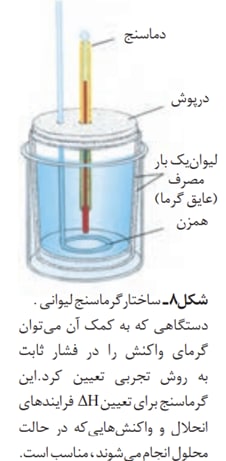
اما همیشه راه مستقیم میسر نیست و نیاز به یکسری روش های غیر مستقیم حس میشود. یکی از این راه ها از طریق استفاده از انرژی پیوند میباشد.
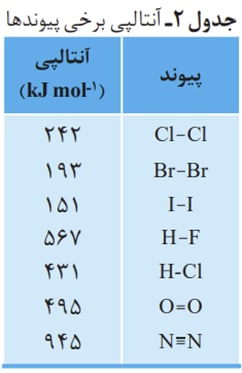
هر پیوند موجود بین دو اتم متفاوت و یا یکسان یک انرژی پیوند دارد که با برقراری پیوند آزاد و با شکستن پیوند گرفته میشود.
یکسری از این انرژی پیوند ها به طور مستقیم قابل اندازه گیری هستند:
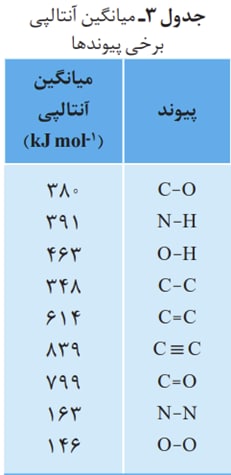
در حالی که برای بعضی دیگر از پیوند ها مجبوریم محاسباتی انجام دهیم و با میانگین گیری بین حالت های مختلف میانگین آنتالپی پیوند را محاسبه کنیم :
یک راه غیر مستقیم بدست آوردن آنتالپی یک واکنش از طریق انرژی پیوند میباشد که میتوان در نظر گرفت که در هنگام انجام یک واکنش شیمیایی پیوند های موجود بین اتم های مواد واکنش دهنده همگی میشکنند و برای شکستن آنها یک انرژي ای که برابر مجموع انرژی پیوند بین این اتم ها است مصرف میشود و بعد از این مرحله بین این اتم های رها شده پیوند هایی شکل میگیرد که مولکول های مواد فرآورده را میسازد و با تشکیل این پیوند ها به اندازه مجموع انرژی پیوند های تشکیل شده گرما آزاد میشود.

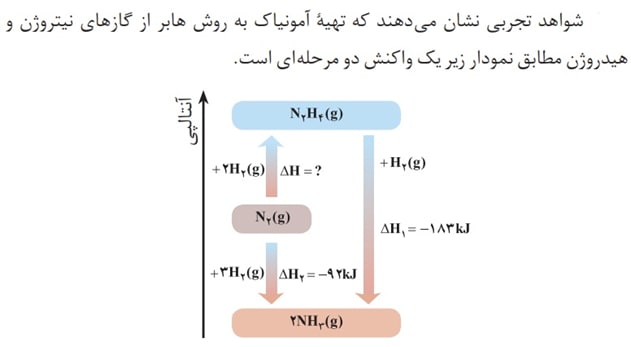
یک راه غیر مستقیم دیگر برای محسابه آنتالپی یک واکنش استفاده از قانون هس میباشد.
قانون هست بیان میکند که اگر معادله واکنشی را بتوان از جمع معادله دو یا چند واکنش دیگر به دست آورد، H ∆آن نیز از جمع جبری H ∆همان واکنشها به دست می آید. به این مثال دقت کنید :

نمودار های زیر به درک مسائل گرماشیمی کمک شایانی میکنند :
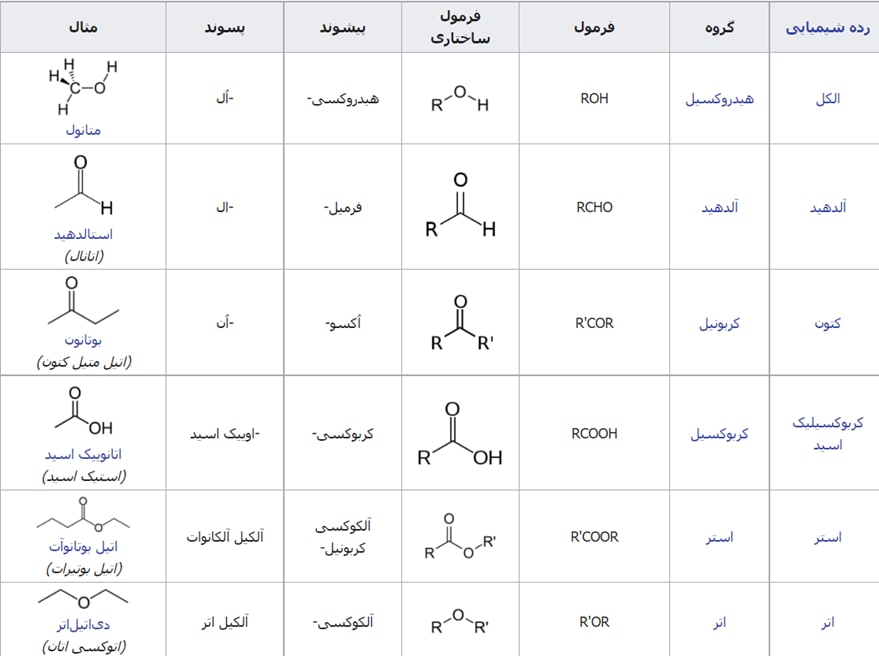
گروه های عاملی آرایش های ویژه ای از اتم ها در مولکول های آلی میباشند که به این مولکول ها خواص ویژه ای میدهند. در هر یك از این گروه ها شیوه اتصال اتم ها به یكدیگر یا پیوند میان آنها اهمیت ویژه ای دارد.
طبق متن کتاب درسی گروه عاملی آلدهیدی و کتونی هر دو گروه کربونیل مجسوب میشوند.
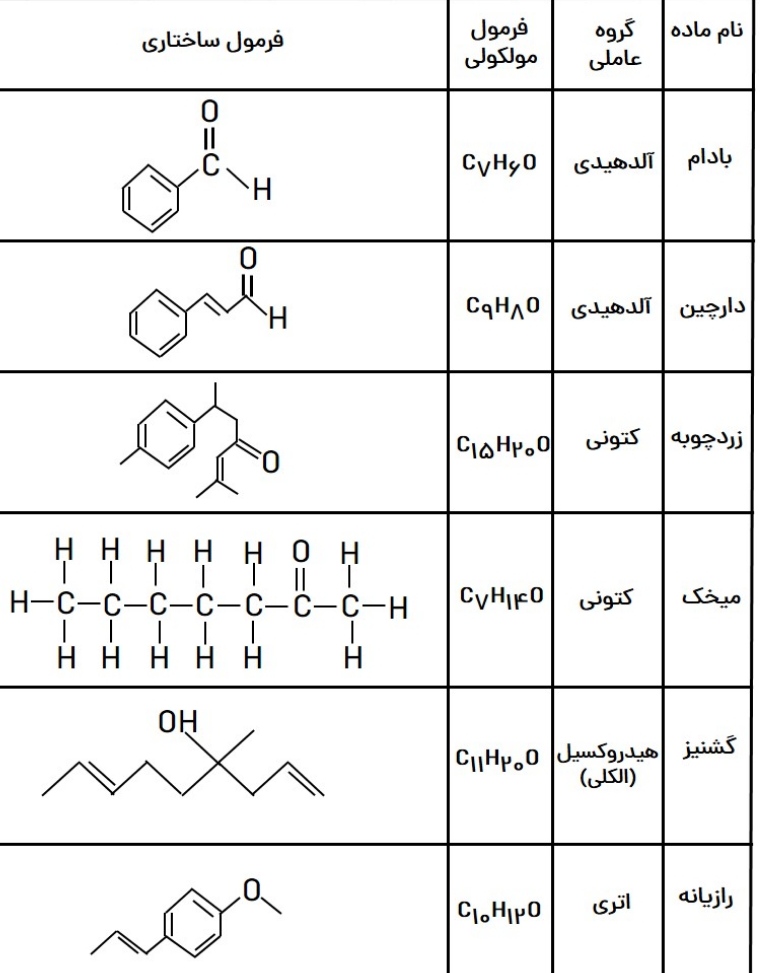
جدول های زیر خلاصه ای از گروه های عاملی طی فصل ۲ و ۳ شیمی یازدهم میباشد و جدول بعدی مولکول های حائز اهمیت دارای این گروه های عاملی
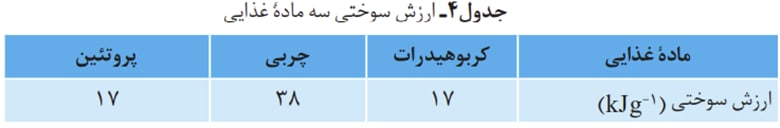
ارزش سوختی عبارت است از مقدار گرمایی که در ازای سوزاندن یک گرم ماده آزاد میشود.
ارزش سوختی سه ماده غذایی کربوهیدرات ، چربی و پروتئین برای ما حائز اهمیت میباشد.
بدن ما از غذا، مواد گوناگونی دریافت می كند. این مواد شامل كربوهیدرات ها، چربی ها، پروتئین ها، آب، ویتامین ها و مواد معدنی بوده كه سه ماده نخست ، افزون بر تأمین مواد اولیه برای سوخت وساز یاخته ها ، منابعی برای تأمین انرژی آنها نیز هستند. در این میان تنها کربوهیدرات ها هستند كه در بدن به گلوکز شکسته شده و گلوکز حاصل از آنها در خون حل میشود. خون این ماده را به یاخته ها میرساند (گلوکز، قندخون است) و این ماده هنگام اکسایش در یاخته ها، انرژی تولید میکند ؛ این روند به آسانی انرژی مورد نیاز یاخته ها را تأمین میکند.
اما بدن انسان بیشتر چربی ذخیره میکند و دلیل آن بیشتر بودن ارزش سوختی چربی ها میباشد.
آنتالپی سوختن عبارت است از مقدار گرمایی که از سوزاندن یک مول ماده آزاد میشود.
مقایسه های زیر را به خاطر داشته باشید :
برای مقایسه گرمای واکنش سوختن هیدروکربن ها هر نمونه ماده ای که جرم کل بیشتری دارد گرمای حاصل از سوختن آن بیشتر است.
در تعداد کربن برابر مقایسه آنتالپی سوختن به این صورت میباشد :
آلکان>آلکن>آلکل>آلکین
با افزایش تعداد کربن ارزش سوختی آلکان ها کاهش میابد.
ارزش سوختی با تعداد کربن برابر :
آلکان>آلکن>آلکین>الکل
در الکل ها با افزایش تعداد کربن ارزش سوختی افزایش میابد.
سوخت های سبز در ساختار خود افزون بر هیدروژن و کربن، اکسیژن نیز دارند و از پسماندهای گیاهانی مانند سویا، نیشکر و دیگر دانه های روغنی استخراج میشوند.
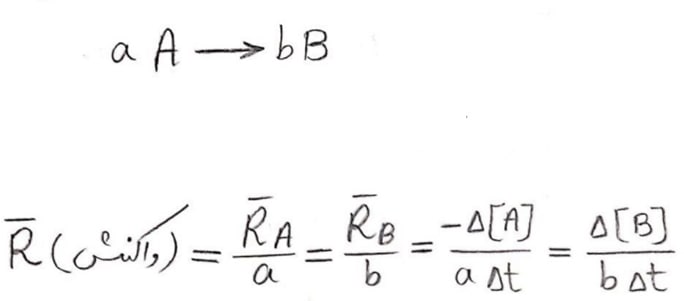
یکی دیگر از شاخه های علم شیمی ، سینتیک میباشد که علم بررسی و مطالعه ی سرعت انجام واکنش های شیمیایی و عوامل تاثیرگذار روی آن میباشد.
آهنگ واكنش معیاری برای زمان ماندگاری مواد است، كمیتی كه نشان میدهد هر تغییر شیمیایی در چه گستره ای از زمان رخ میدهد.

عوامل تاثیرگذار بر سرعت واکنش:
ماهیت واکنش دهنده ها : هرچه واکنش دهنده تر باشد واکنش سریع تر است.
غلظت واکنش دهنده ها(مقدار مدنظر نیست!) : نسبت مستقیم با سرعت
سطح تماس : نسبت مستقیم با سرعت
دما : نسبت مستقیم با سرعت (چه واکنش گرماده باشد و چه گرماگیر)
کاتالیزگر : افزایش سرعت واکنش در صورت استفاده از کاتالیزگر
موادی مانند نگه دارنده ها : با افزوده شدن سرعت واکنش را کاهش میدهند.
فشار محیط(فقط در واکنش هایی که واکنش دهنده ی گاز دارند)
شعله آتش گرد آهن موجود در کپسول چینی را داغ و سرخ میکند ولی پاشیدن و پخش کردن گردآهن بر روی شعله موجب سوختن آن میشود که نشان دهنده ی اثر سطح تماس میباشد.
کاتالیزگر تجزیه هیدروژن پراکسید ، محلول پتاسیم یدید میباشد.
با افزایش دما محلول پتاسیم پرمنگنات با یک اسید آلی محلول به سرعت بی رنگ میشود که نشان دهنده تاثیر دما بر سرعت است.
الیاف آهن داغ و سرخ شده در هوا نمیسوزد ولی الیاف آهن داغ و سرخ شده در یک ارلن پر اکسیژن میسوزد که نشان دهنده تاثیر غلظت بر سرعت است.
محاسبه ی سرعت واکنش به شکل کمی :
بررسی نمودار های غلظت-زمان
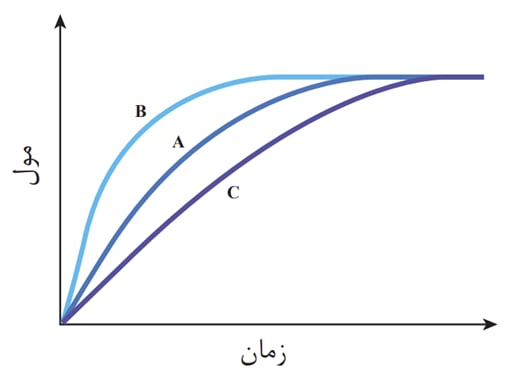
با توجه به نمودار بالا نمودار A مربوط به حالت عادی یک واکنش و نمودارB مربوط به زمانی است که از کاتالیزگر استفاده کردیم به همین علت مشاهده میشود که زود تر از حالت قبل مقدار مول فرآورده به حداکثر خود میرسد ، همچنین نمودارC نمایانگر زمانی است که ازیک بازدارنده استفاده کرده ایم و مشاهده میکنیم که با کند شدن واکنش دیر تر از دو حالت قبلی بمقدار فرآورده به حداکثر مقدار خود میرسد.
اضافه کردن کاتالیزگر بر مقدار فرآورده تاثیر نمیگذازد همچنین کاتالیزگر در انتهای واکنش دست نخورده باقی میماند و میتوان از آن بار ها اسفاده کرد.
شیب نمودار غلظت-زمان یا مقدار ماده-زمان برابر با سرعت واکنش میباشد.
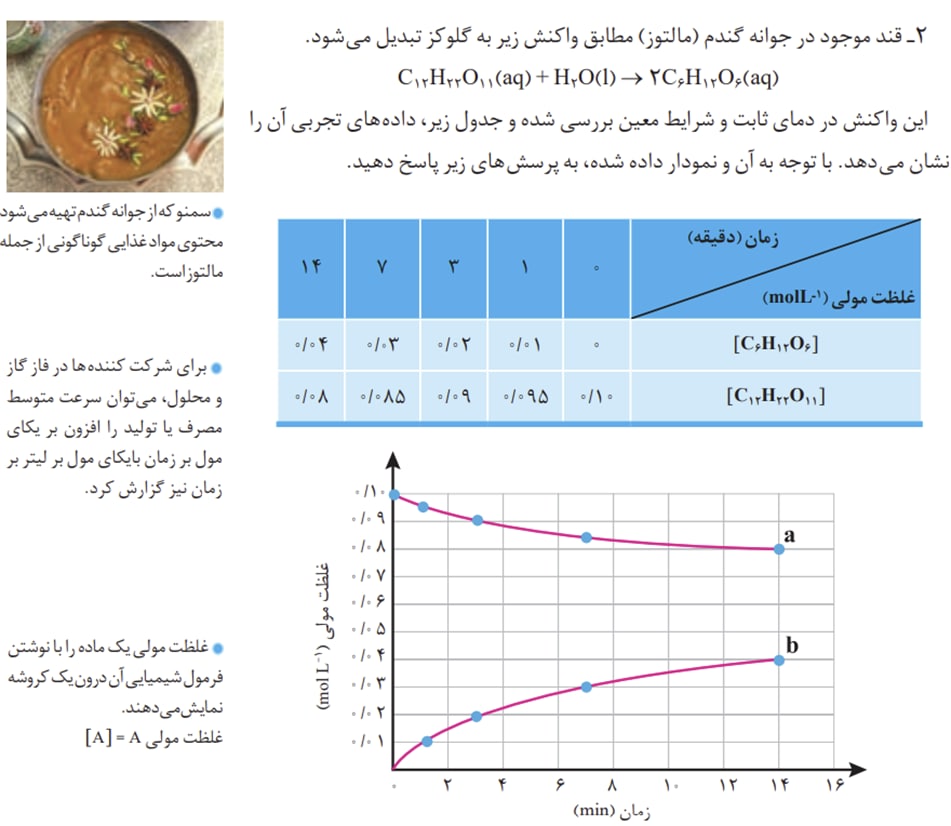
در نمودار های غلظت-زمان نموداری که شیب مثبت دارد نمودار غلظت فرآورده و نموداری که شیب منفی دارد نمودار غلظت واکنش دهنده میباشد. به واکنش شکل زیر دقت فرمایید.
برای رزرو مشاوره و رفع اشکال درسی و شرکت در کلاس های کنکوری با مشاوران سایت برترها بر روی لینک زیر کلیک کنید یا با شماره تماس 0216463 داخلی1174(حیدریان) تماس بگیرید.
مطالب مرتبط:
قدر هدایای زمینی را بدانیم-شیمی یازدهم-پرهام علی پور