سلام دوستان عزیز
در این مطلب می خواهیم به جمع بندی خلاصه نکات و حفظیات فصل دوم شیمی یازدهم مطابق با بودجه بندی آزمون های جمع بندی و کنکور بپردازیم.
| دانشجوی مهندسی عمران دانشگاه تهران رتبه 328 منطقه دو - کنکور ریاضی 1398 |
برای ارتباط بیشتر با برترها و رزرو پشتیبان ویژه، پیج کانون برترها را دنبال کنید، همچنین میتونید با شماره ۰۲۱۸۴۵۱ داخلی ۳۱۲۳ تماس بگیرید.
بودجه بندی فصل اول در کنکور سال های اخیر
دمای ماده از چه خبر می دهد؟
دما کمیتی است که میزان گرمی و سردی مواد را نشان می دهد. از دیدگاه ذره ای، ذره های سازنده ی ماده همواره در حال جنب و جوش هستند. اما در حالت های فیزیکی متفاوت، میزان جنبش ذرات متفاوت از یکدیگر است.
نکته: به طور کلی این جنبش های نامنظم در حالت گاز شدیدتر از مایع و در حالت مایع نیز شدیدتر از حالت جامد است.
نکته:«دمای یک ماده معیاری برای توصیف میانگین تندی و میانگین انرژی جنبشی ذرات سازنده آن است.»
نکته: در دمای معین یک ویژگی مشترک مواد با هر حالتی، وجود جنبش های نامنظم ذرات سازنده ی آن هاست و هر چه دمای ماده بالاتر رود، میانگین تندی و میانگین انرژی جنبشی ذرات بیشتر است.
تفاوت دما و گرما
همانطور که می دانیم، انجام یک فرآیند می تواند باعث تغییر دمای یک ماده شود. به آن مقدار انرژی گرمایی که به دلیل تفاوت در دما جاری می شود، گرما می گویند.
•جهتِ جاری شدن انرژی گرمایی، از ماده ای با انرژی گرمایی بیشتر به ماده ای با انرژی گرمایی کم تر نیست، بلکه از ماده ای با دمای بالاتر (که ممکن است انرژی گرمایی کم تری داشته باشد) به ماده ای با دمای پایین تر می باشد.
•دما و انرژی گرمایی هر دو برای توضیف یک نمونه ماده به کار می روند، ولی گرما از ویژگی های یک نمونه ماده نیست. تغییر دما و گرما هر دو، برای توصیف یک فرآیند به کار می روند.
•گرما را با Q نشان می دهند، یکای اندازه گیری گرما در «SI» ژول (J) است ولی از کالری (cal) هم برای بیان مقدار گرما استفاده می شود. 1J = 1 kg.m2.s-2 1cal = 4.18 J
ظرفیت گرمایی و گرمای ویژه
به مقدار گرمای مورد نیاز برای افزایش دمای یک جسم به اندازه یک درجه سلسیوس، ظرفیت گرمایی آن جسم گویند که با حرف (C) نمایش داده می شود.
J.C-1 یا J.K-1 = یکای(C) Q=C∆θ
نکته: ظرفیت گرمایی یک ماده در دما و فشار ثابت به نوع ماده و مقدار آن بستگی دارد. بنابراین هر چه جرم جسمی بیش تر باشد، ظرفیت گرمایی آن نیز بیشتر است.
به مقدار گرمای لازم برای افزایش دمای یک گرم از یک جسم به اندازه ی (℃1) ظرفیت گرمایی ویژه آن جسم گفته می شود که با حرف (c) نمایش داده می شود. Q=mc∆θ
•دما با گرمای ویژه رابطهء عکس دارد. به طور کلی هر چه گرمای ویژهء ماده ای بزرگتر باشد، مقاومت آن در برابر تغییر دما بیشتر خواهد بود؛ یعنی دمای آن کم تر تغییر می کند.
جاری شدن انرژی گرمایی
فرآیند هایی که با تبادل گرما همراه هستند به دو دسته تقسیم می شوند:
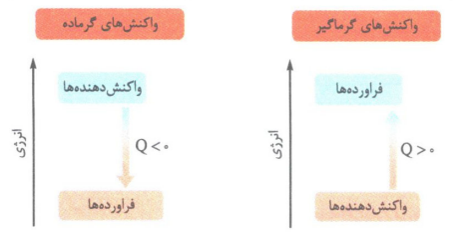
فرآیند های گرماده: در این فرآیند ها انرژی به صورت گرما از سامانه به محیط جاری می شود و دمای سامانه کاهش می یابد. Q<0
فرآیند های گرماگیر: در این نوع فرآیند ها انرژی به صورت گرما از محیط به سامانه منتقل می شود و دمای سامانه افزایش می یابد. Q>0
نکته: در فرآیند های گرماگیر علامت گرما در سمت واکنش دهنده ها و در فرآیند های گرماده علامت گرما در سمت فرآورده ها نوشته می شود.
تغییر حالت فیزیکی مواد خالص با تغییر انرژی همراه است. برخی از این تغییرها گرماگیر و برخی دیگر گرماده اند.
واکنش گرماده و گرماگیر
به ساخه ای از علم شیمی که به بررسی کمی و کیفی گرمای واکنش های شیمیایی، تغییر آن و تاثیری که بر حالت ماده دارد، ترموشیمی یا گرماشیمی می گویند.
واکنش ها بر نیز بر اساس این که در طی واکنش گرما آزاد شده یا گرما جذب شود، به دو دسته تقسیم می شوند:
انرژی یک سامانه با پایداری آن رابطهء عکس دارد؛ به عبارت دیگر هر چه انرژی سامانه بیشتر باشد، آن سامانه ناپایدارتر است.
-
مبادله گرما بر اثر انجام واکنش در دمای ثابت
اگر یک واکنش در دمای ثابت انجام شود، یعنی دمای مواد واکنش دهنده پیش از آغاز واکنش با دمای مواد فراورده پس از پایان واکنش برابر باشد، باز هم میان سامانه واکنش و محیط پیرامون، گرما دادوستد خواهد شد. شیمیدان ها گرمای جذب یا آزاد شده در هر واکنش شیمیایی را به طور عمده وابسته به تفاوت میان انرژی پتانسیل مواد واکنش دهنده و فراورده می دانند. انرژی پتانسیل یک نمونه ماده، انرژی نهفته در آن بوده و هم ارز با انرژی ناشی از نیروهای نگهدارنده ذره های سازنده آن است.
•گرمای جذب یا آزاد شده در واکنشی که در دمای ثابت انجام می شود، ناشی از تفاوت انرژی گرمایی (مجموع انرژی جنبشی ذره ها) در مواد واکنش دهنده و فراورده نیست؛ زیرا در دمای ثابت، تفاوت چشمگیری میان انرژی گرمایی آنها وجود ندارد.
•با انجام یک واکنش شیمیایی، شیوه اتصال اتم ها به یکدیگر تغییر می کند و همین امر باعث تفاوت آشکاری در انرژی پتانسیل وابسته به آنها شده و این تفاوت انرژی، در واکنش به شکل گرما ظاهر می شود.
• الماس و گرافیت دو دگرشکل (آلوتروپ) معروف کربن هستند. شیوه اتصال اتم های کربن به یکدیگر در این دو آلوتروپ متفاوت است؛
عوامل موثر بر گرمای واکنش
1- نوع مواد واکنش دهنده و فرآورده: هر ماده در دما و فشار ثابت، انرژی معینی دارد، یعنی سطح انرژی مواد با هم متفاوت است؛ بنابراین گرمای واکنش ها با تغییر نوع ماده، تغییر می کند.
2- دما و فشار: سطح انرژی مواد به دما و فشار بستگی دارد؛ بنابراین برای تعیین گرمای یک واکنش، باید واکنش مورد نظر در یک فشار معین و دمای ثابت انجام شود.
3- مقدار واکنش دهنده ها: هر چه مقدار مواد واکنش دهنده بیشتر باشد، مقدار گرمای مبادله شده نیز بیشتر خواهد بود.
4- حالت فیزیکی واکنش دهنده ها و فرآورده ها: حالت فیزیکی مواد شرکت کننده در یک واکنش باید مشخص باشد، زیرا انرژی مواد در حالت های فیزیکی مختلف، متفاوت است. به طور کلی سطح انرژی یک ماده در حالت گاز بیشتر از حالت مایع و آن هم بیشتر از حالت جامد می باشد.
جامد < مایع < گاز : سطح انرژی یک ماده در حالت های فیزیکی مختلف
تست 1:

تست 2:

مفهوم آنتالپی
انرژی کل یک سامانه هم ارز با محتوی انرژی یا آنتالپی آن می باشد. بنابراین هر سامانه در دما و فشار ثابت آنتالپی معینی دارد.
در واکنش های گرماگیر مواد با آنتالپی کم تر به مواد با آنتالپی بیش تر تبدیل می شوند.
در واکنش های گرماده مواد با آنتالپی بیش تر به مواد با آنتالپی کم تر تبدیل می شوند.
آنتالپی پیوند و میانگین آن
به مقدار انرژی لازم برای شکستن یک مول از پیوند های اشتراکی در حالت گازی و تبدیل آن ها به اتم های سازنده گازی شکل، آنتالپی پیوند گفته می شود. . به عنوان مثال برای شکستن پیوندهای موجود در یک مول (H2)g و تبدیل آن به دو مول اتم هیدروژن گازیkJ ٤٣٦ انرژی لازم است.
بنابراین از آنجا که شکستن یک پیوند همواره گرماگیر است آنتالپی آن همیشه مثبت است.
نکته: در مولکول هایی مانند NH3، CH4، H2O که اتم مرکزی در آن ها به چند اتم یکسان با پیوند اشتراکی متصل است. از واژه میانگین آنتالپی پیوند استفاده می شود چون انرژی لازم برای شکستن این پیوند ها یکسان نیست.
نکته: آنتالپی واکنش تشکیل پیوند قرینه آنتالپی پیوند است.
نکته: آنتالپی پیوند های متفاوت به دو عامل وابسته است:
1) مرتبه پیوند (تعداد پیوند های بین دو اتم): هر چه مرتبه پیوند بیش تر باشد، انرژی پیوند بیش تر است.
2) شعاع اتم های تشکیل دهنده پیوند: هرچه شعاع اتم های تشکیل دهنده پیوند بیش تر باشد، آنتالپی پیوند کوچک تر است.
آنتالپی سوختن:
سوختن تغییر شیمیایی است که طی آن یک ماده به سرعت واکنش می دهد و انرژی زیادی به صورت گرما آزاد می کند. آنتالپی واکنشی را که در آن یک مول از ماده در مقدار اکسیژن کافی بسوزد، آنتالپی سوختن آن ماده می نامند که دارای واحد کیلوژول بر مول و علامت منفی است.
نکته: یکی از فرآورده های سوختن مواد آلی به صورت H2O است که به صورت مایع است.
نکته: هر چه جرم هیدروکربنی بیش تر باشد، گرمای حاصل از سوختن آن بیش تر است.
نکته: گرمای حاصل از سوختن آلکان ها از الکل های هم کربن خودشان بیش تر است.
گروه های عاملی مهم اکسیژن دار
گروه کربونیل
این گروه عاملی مختص آلدهید ها و کتون هاست. در آلدهید ها این گروه عاملی در ابتدای زنجیره کربنی قرار می گیرد و از یک سمت حتما به H متصل است. مانند بنزآلدهید. ولی در کتون ها این گروه عاملی از هر دو سمت به کربن متصل است.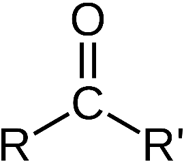
گروه هیدروکسیل
این گروه عاملی مختص الکل ها است. مانند ترکیب آلی موجود در گشنیز که سبب طعم و بوی آن می شود.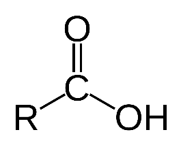
گروه اتری
این گروه مختص اتر هاست. مانند ترکیب آلی موجود در رازیانه که موجب ایجاد طعم و بوی آن می شود.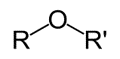
ایزومر
به موادی که فرمول مولکولی یکسان ولی ساختار متفاوتی دارند، ایزومر یا هم پار گفته می شود.
ایزومر ها دارای خواص فیزیکی و شیمیایی متفاوتی هستند و محتوی انرژی آن ها نیز با هم متفاوت است.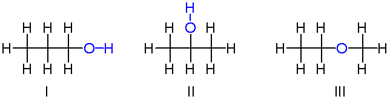
نکته: آلدهید ها و کتون های سیر شده و هم کربن ایزومر هستند.
نکته: الکل ها و اترهای سیر شده و هم کربن نیز ایزومر هستند.
تست 3:

تست 4:

آهنگ واکنش:
آهنگ واکنش کمیتی است که نشان می دهد هر تغییر شیمیایی در چه مدت زمانی انجام می شود؛ هرچه مدت زمان انجام یک واکنش کم تر باشد، آهنگ انجام آن تند تر است و واکنش سریع تر انجام می شود.
شیمی دان ها آهنگ انجام واکنش را در گسترهء معینی از زمان به نام سرعت واکنش بیان می کنند. زمان انجام واکنش ها می تواند گستره ای ازچند صدم ثانبه تا چند سده را در بر گیرد.
سرعت واکنش از دیدگاه کمی:
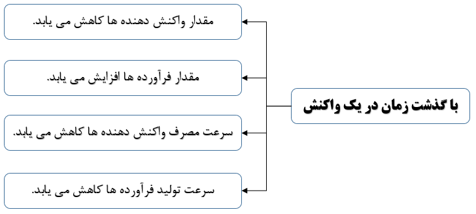
از آنجا که در یک واکنش شیمیایی با گذشت زمان، واکنش دهنده ها مصرف و فرآورده ها تولید می شوند. می توان آهنگ مصرف واکنش دهنده ها و تولید فرآورده ها را در بازه ای از زمان اندازه گیری کرد.
سرعت مصرف یا تولید آن ماده در گستره ی زمانی قابل اندازه گیری(R>0) در واکنش فرضی A→B
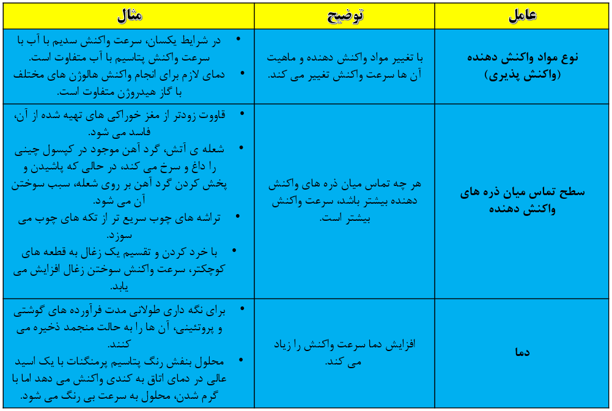
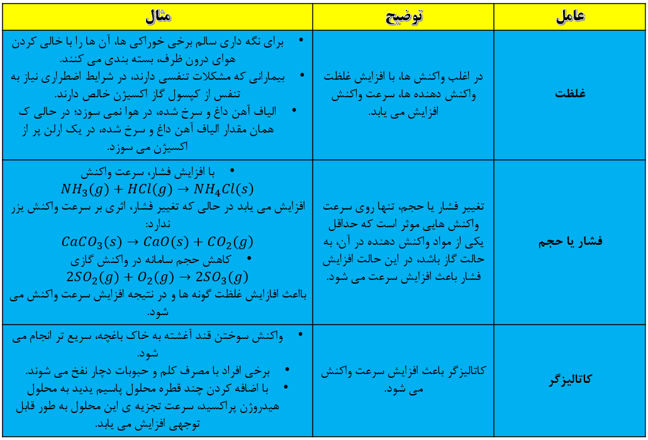
سرعت انجام واکنش به نوع مواد واکنش دهنده، سطح تماس واکنش دهنده ها، غلظت واکنش دهنده ها، دما و کاتالیزگر وابسته است.
سرعت واکنش: اگر سرعت تولید یا مصرف هر یک از مواد شرکت کننده در واکنش را بر ضریب استوکیومتری آن ماده تقسیم کنیم، سرعت متوسط واکنش حاصل می شود.
سرعت متوسط واکنش گازی: aA → bB
از رابطه زیر به دست می آید: 
آشنایی اولیه با کربوکسیلیک اسیدها
کربوکسیلیک اسیدها دسته ای از ترکیب های آلی هستند که در ساختار آن ها یک یا چند گروه عاملی کربوکسیل وجود دارد.
1- آشناترین عضو خانوادهء کربوکسیلیک اسیدها، اتانوییک اسید (استیک اسید) با فرمول (C2H4O2)CH3COOH است.
2- از بنزوئیک اسید که یک عضو خانوادهء کربوکسیلیک اسیدها است، در صنایع غذایی به عنوان نگهدارنده استفاده می شود. نگهدارنده ها، سرعت واکنش واکنش شیمیایی را که منجر به فساد مواد غذایی می شوند، کاهش می دهند.
فرمول مولکولی بنزوئیک اسید C7H6O2 بوده و از ساختار آن به صورت رو به رو است:
•در ساختار بنزوئیک اسید، یک حلقهء بنزنی وجود دارد؛ بنابراین این ترکیب، آروماتیک محسوب می شود.
•بنزوئیک اسید در تمشک و توت فرنگی وجود دارد.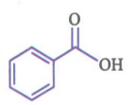
تست 5:
در ظرفی به حجم 5 لیتر، 1023 × 3.01 مولکول آمونیاک را در شرایط مناسب قرار می دهیم تا به گازهای هیدروژن و نیتروژن تجزیه شود. اگر پس از 80 ثانیه از شروع واکنش، مجموع شمار مولکول های درون ظرف برابر 1023 × 4.0214 باشد، سرعت تولید گاز هیدروژن بر حسب mol.L-1.min-1 کدام است؟
1) 0.15 2) 0.045 3) 0.015 4) 0.45
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ، فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
با آرزوی موفقیت و کامیابی



