سلام
در این مطلب میخواهیم با هم به جمع بندی نکات صفحه 51 تا 64 (مطابق با آزمون جامع) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
عدد اکسایش
عدد اکسایش یک اتم در ترکیب برابر با تعداد بارهای مثبت یا منفی است که به آن اتم نسبت داده می شود.
نکات مهم برای بدست آوردن عدد اکسایش:
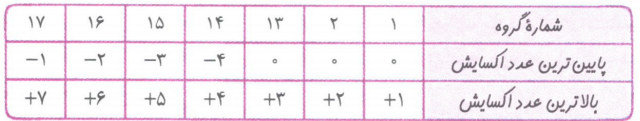
1-عدد اکسایش یک یون تک اتمی برابر بار یون است.
2-عدد اکسایش عنصر به حالت آزاد صفر است.
3-عدد اکسایش هیدروژن در ترکیب ها 1+ است بجز در هیدرید های فلزی.
4-عدد اکسایش اکسیژن در ترکیب ها 2- است. بجز در OF2 که 2+ و در پراکسیدها که 1- است.
5-مجموع عدد اکسایش اتم های سازنده یک مولکول برابر صفر است.
6-مجموع عدد اکسایش اتم های سازنده ی یک یون چند اتمی برابر بار یون است.
7-عدد اکسایش فلزهای قلیایی در ترکیب ها 1+ و قلیایی خاکی 2+ است.
8-عدد اکسایش می تواند برای یک اتم در ترکیبات گوناگون متفاوت باشد.
تعیین عدد اکسایش به روش رسم ساختار لوویس
برای تعیین عدد اکسایش اتم ها در مواد مولکولی یا یون های چند اتمی از رابطه زیر استفاده می کنیم
شمار الکترون های نسبت داده شده – شمارالکترون های ظرفیت = عدد اکسایش اتم
همان طور که میدانید شمار الکترون های ظرفیت برای عنصرهای گروه ۱ و ۲ همان شماره گروه و برای عنصرهای گروه ۱۳ به بعد، برابر با یکان شماره گروه است.
برای تعیین شمار الکترون های نسبت داده شده به هر اتم، پس از رسم ساختار لوویس گونه مورد نظر، به صورت زیر عمل می کنیم و به ازای هر جفت الکترون پیوندی میان دو اتم یکسان، یک الکترون به هر اتم نسبت می دهیم. و به ازای هر جفت الکترون پیوندی میان دو اتم متفاوت، هر دو الکترون را به اتم با خصلت نافلزی بیشتر نسبت می دهیم. و همه الکترون های ناپیوندی روی هر اتم را به همان اتم نسبت می دهیم.
در محاسبه عدد اکسایش اتم ها بهتر است مقایسه خصلت نافلزی چند عنصر زیر را بلد باشین!
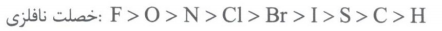

نکته: اگر در واکنشی عنصر به حالت آزاد در واکنش دهنده ها یا فرآورده ها وجود داشته باشد، حتما از نوع اکسایش – کاهش است و چون عدد اکسایش عنصر به حالت آزاد صفر است و هنگامی که در ترکیب است تغییر کرده و صفر نیست.
نکته: اگر در واکنشی عنصر به حالت آزاد در سمت چپ یا راست معادله وجود داشته باشد، باید عدد اکسایش عنصر ها را بررسی کنیم که اگه تغییری در عدد اکسایش رخ داده باشد از نوع اکسایش – کاهش است و در غیر این صورت اکسایش – کاهش است.
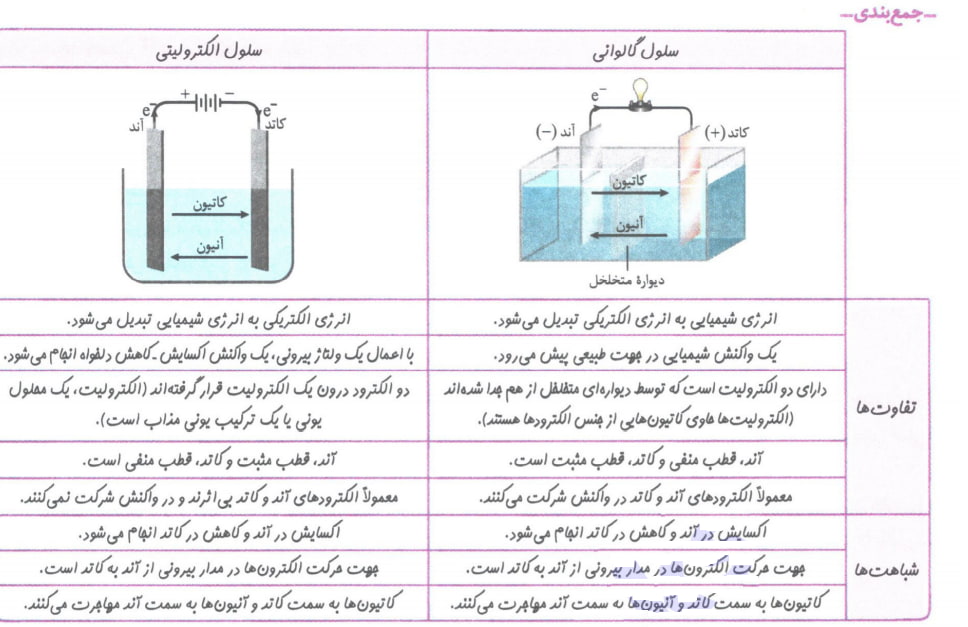
سلول الکترولیتی
در این نوع سلول های الکتروشیمیایی با اعمال یک ولتاژ بیرونی و عبور جریان الکتریکی از درون محلول الکترولیت می توان یک واکنش شیمیایی را در خلاف جهت طبیعی آن پیش راند.
ویژگی های سلول الکترو شیمیایی
1-دو الکترود در یک الکترولیت قرار دارند، الکترودهای بی اثری که اغلب گرافیتی هستند.
2-انرژی الکتریکی به انرژی شیمیایی تبدیل می شود.
3-اکسایش در آند و کاهش در کاتد انجام می شود.
4-جهت حرکت الکترون ها در مدار بیرونی از آند به کاتد است.
5-در الکترولیت (محلول یونی یا ترکیب یونی مذاب)، کاتیون ها به سمت کاتد و آنیون ها به سمت آند حرکت می کنند.
6-سطح انرژی فرآورده ها از واکنش دهنده ها بالاتر است.
7-قطب مثبت باتری به آند و قطب منفی به کاتد متصل است. (در سلول گالوانی، کاتد بهقطب مثبت و آند به قطب منفی متصل است.)
برقکافت آب، راهی برای تولید هیدروژن
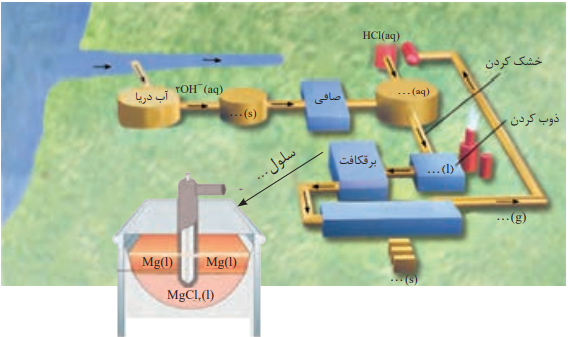
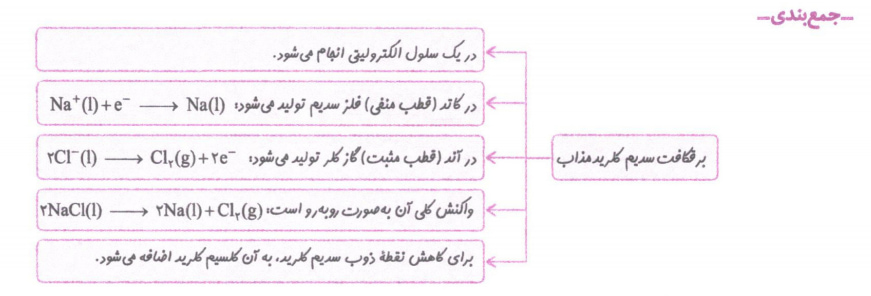
برقکافتNaCl و تهیه ی فلز سدیم
در صنعت فلز سدیم را از برقکافت سدیم کلرید مذاب دریک سلول الکترولیتی به نام سلول دانز که به شکل زیر است، تهیه می کنند.
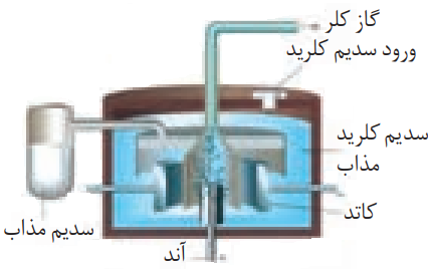
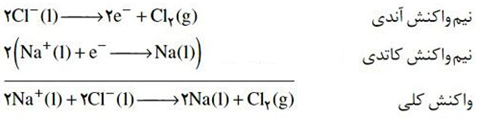
تهیه ی فلز منیزیم
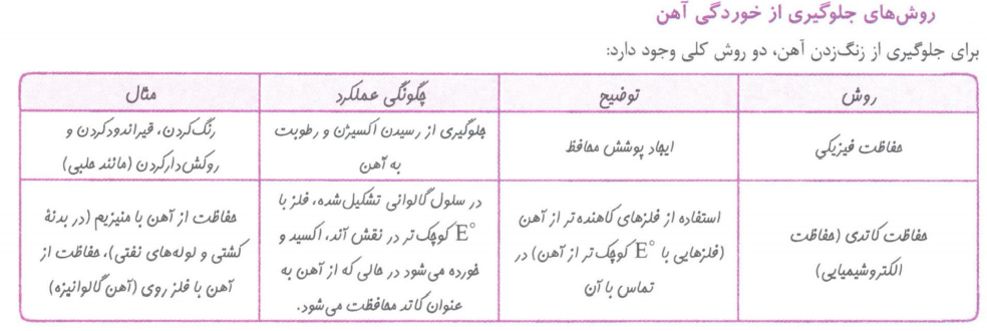
خوردگی آهن
به ترد شدن، خرد شدن و فرو ریختن فلز ها بر اثر واکنش اکسایش – کاهش خوردگی گفته می شود.
توجه: زنگ زدن آهن، تیره شدن نقره، تشکیل زنگار سبز رنگ بر روی مس نمونه هایی از خوردگی فلزها هستند.
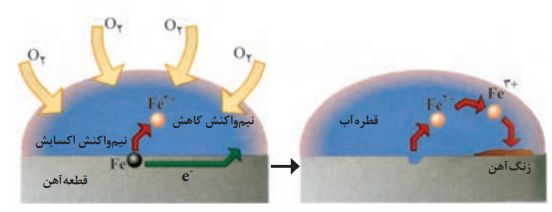
•هنگامی که فلزها در هوا قرار می گیرند، اغلب اکسایش یافته و به شکل اکسید در می آیند. در برخی فلزها مانند آهن با ادامه اکسایش، لایه ای ترد و شکننده تشکیل می شود که به تدریج فرو می ریزد. به این حالت خوردگی گویند.
•فلزهای طلا (Au) و پلاتین (Pt) حتی در محیط اسیدی دچار خوردگی نمی شوند. این فلزها را فلزهای نجیب می نامند.
نکته: از آنجا که پتانسیل کاهشی اغلب فلزها منفی و پتانسیل کاهشی اکسیژن مثبت است، اکسیژن به عنوان اکسنده تمایل دارد با گرفتن الکترون از فلزها، آن ها را اکسید کند.
شکل زیر مراحل زنگ زدن آهن در حضور رطوبت و اکسیژن را نشان می دهد.
فداکاری فلزها
یکی از راه های محافظت آهن از خوردگی، جلوگیری از رسیدن اکسیژن و رطوبت به آن است، که به روش های زیر می توان آن را انجام داد.
1) استفاده از رنگ (رنگ کردن)
2) پوساندن سطح آهن با مواد نفتی مانند و قیر(قیر اندود کردن)
3) پوشاندن سطح آهن با فلز دیگری مانند قلع (Sn) یا روی (Zn) که در برابر خوردگی مقاوم است. (روکش کردن)
•راه دیگر برای جلوگیری از زنگ زدن آهن که به طور گسترده در صنعت کاربرد دارد. اتصال آهن به یک فلز مانند منیزیم یا روی است.
•اگر قطعه ای از فلز منیزیم به یک جسم ساخته شده از آهن متصل باشد، منیزیم در نقش آند از بین می رود و آهن در نقش کاتد، حفاظت شده و سالم می ماند. نیم واکنش های انجام شده عبارت اند از:
نکته: آهن متصل، در نقش کاتد حفاظت شده و خورده نمی شود.
برخی فلزها مانند آلومینیم (Al)، روی (Zn) و قلع (Sn)، اکسید فشرده و مقاومی در سطح خود تشکیل می دهند که بقیه ی فلز را از دسترس هوا و رطوبت دور نگه می دارد. این لایه ی اکسید باعث می شود فلز در برابر خوردگی مقاوم باشد.
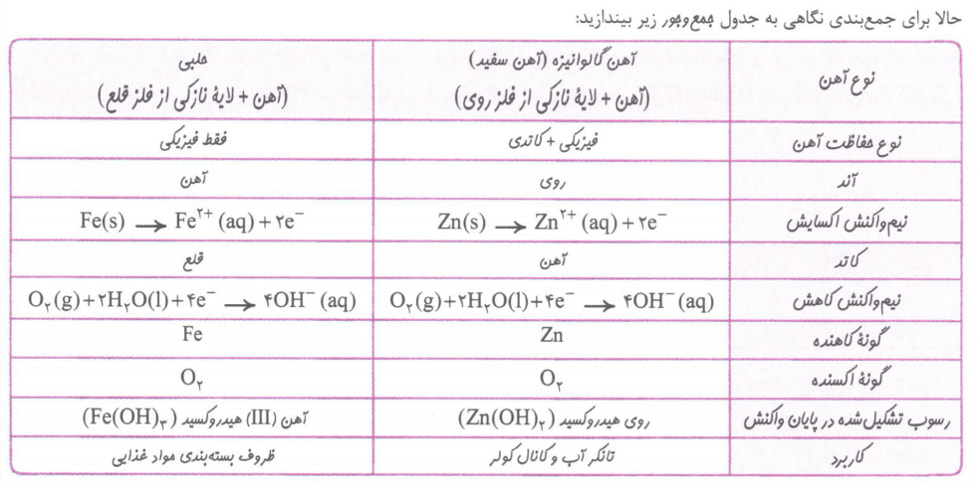
آهن گالوانیزه یا آهن سفید، ورقه آهنی است که با لایه ی نازکی از فلز روی (Zn) پوشیده شده است و حلبی ورقه آهنی است که با لایه ی نازکی از فلز (Sn) پوشیده شده است.
اگر خراشی در سطح آهن گالوانیزه ایجاد شود، در حضور رطوبت یک سلول الکتروشیمیایی تشکیل می شود که روی (Zn) با E کوچکتر نقش آند و آهن با E بزرگتر نقش کاتد سلول را خواهد داشت.
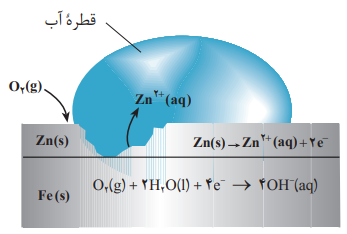
آهن در نقش کاتد حفاظت می شود و روی در نقش آند از بین می رود.
اگر خراشی در سطح حلبی ایجاد شود، در حضور رطوبت یک سلول الکتروشیمیایی تشکیل می شود.
آبکاری
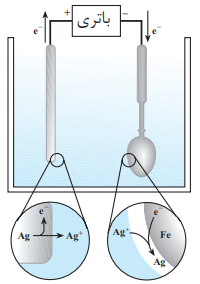
پوشاندن یک فلز با لایه ی نازکی ازیک فلز ارزشمند و مقاوم در برابر خوردگی، به کمک یک سلول الکترولیتی را آبکاری می گویند.
در این روش
1-جسمی که قرار است روکش شود را به کاتد و فلزی که قرار است روکش باشد را به آند متصل می کنند.
2-الکترولیت مورد استفاده در سلول الکترولیتی برای آبکاری باید دارای یون های فلزی باشد که به عنوان روکش انتخاب شده است.
3-نیم واکنش های اکسایش و کاهش هر دو مربوط به فلزی است که روکش می شود.
فرایند هال
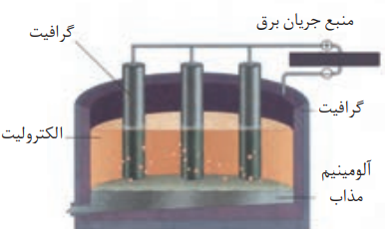
آلومینیم کاهنده تر از آهن است و سریع تر اکسید می شود. اما آلومینیوم برخلاف آن خورده نمی شود.
آلومینیم در طبیعت مانند دیگر فلزهای فعال به حالت آزاد وجود ندارد و به شکل ترکیب یافت می شود. به همین دلیل این فلز تنها از برقکافت نمک های مذاب آن به دست می آید.
1-در فرآیند هال از آند و کاتد گرافیتی استفاده می شود.
2- دیواره ی داخلی ظرف در نقش کاتد و از جنس گرافتی است.
3- میله های گرافیتی در نقش آند به قطب مثبت منبع جریان برق متصل بوده و داخل الکترولیت مذاب قرار دارند.
4- یون آلومینویم موجود در الکترولیت با دریافت الکترون از کاتد به آلومینیم مذاب تبدیل می شوند.
5-چگالی آلومینیم مذاب از الکترولیت داخل ظرف بیشتر است و در زیر قرار می گیرد.
6- بیشترین هزینه در فرآیند هال به صورت مقابل است.
7- واکنش کلی هال به صورت روبرو است:
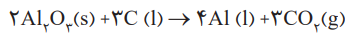
توجه: با دقت در واکنش کلی فرآیند هال، می بینیم که آند گرافیتی در واکنش شرکت کرده و مصرف می شود.
بنابراین با کاهش جرم و لاغر شدن آند گرافیتی، باید جایگزین شوند.

تست های منتخب؛ (تست های زیر را حل کنید و پاسخ آن ها را در کامنت ها به اشتراک بگذارید!)
تست 1

تست 2
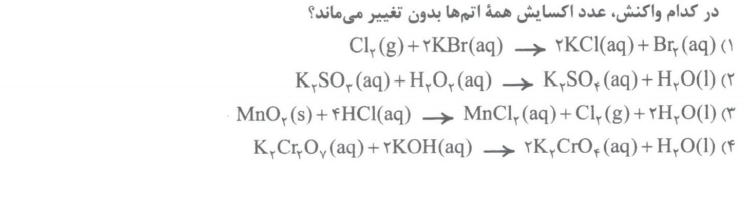
تست 3

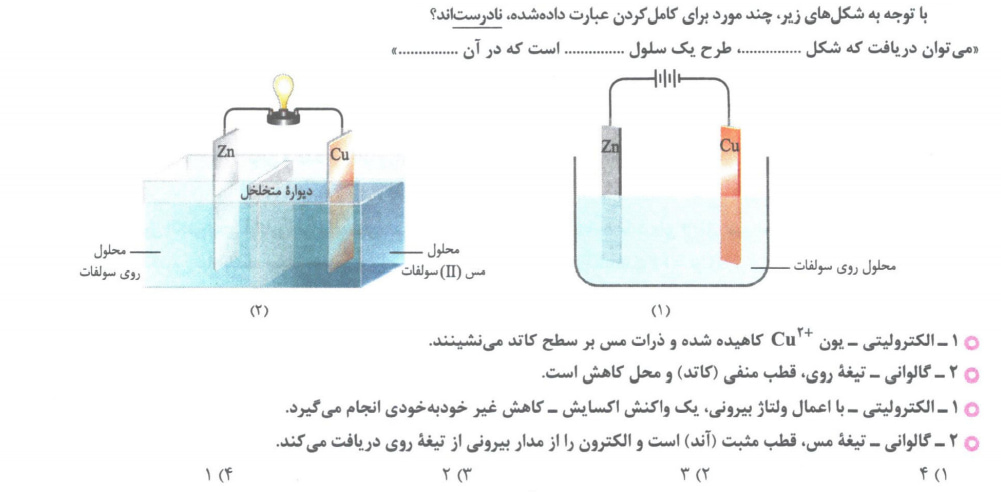
تست 4

تست 5

تست 6

تست 7
دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


