سلام
در این مطلب میخواهیم با هم به جمع بندی نکات سلول سوختی و سلول گالوانی (مطابق با آزمون جامع) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
واکنش هایی که با مبادله ی الکترون بین گونه های واکنش دهنده همراه باشد را واکنش های اکسایش و کاهش می نامند.
اکسایش به معنی از دست دادن الکترون و کاهش به معنای گرفتن الکترون می باشد.
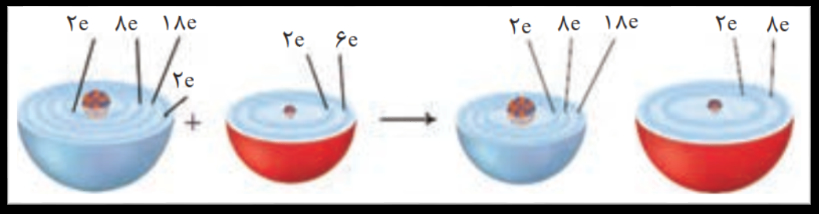
در این واکنش روی الکترون از دست داده و اکسایش یافته در حالی که گاز اکسیژن الکترون گرفته و کاهش یافته است.
مرور اکسایش و کاهش
هر یک از فرآیندهای گرفتن و از دست دادن الکترون با یک نیم واکنش نشان داده می شود.
بنابراین هر واکنش اکسایش – کاهش شامل دو نیم واکنش (نیم واکنش اکسایش و نیم واکنش کاهش است).
گونه ای که الکترون از دست می دهد و اکسایش می یابد سبب کاهش گونه های دیگر می شود. بنابراین کاهنده نامیده می شود.
الکترون دهنده = اکسایش یابنده = کاهنده
گونه ای که الکترون می گیرد و کاهش می یابد سبب اکسایش گونه ی دیگر می شود. بنایراین اکسنده نامیده می شود.
الکترون گیرنده = کاهش یابنده = اکسنده
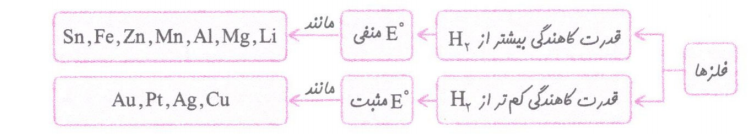
نکته: اغلب فلزها در واکنش با نافلزها تمایل دارند اکسایش یابند و به کاتیون تبدیل شوند. نافلزها نیز تمایل به کاهش دارند و به آنیون تبدیل می شوند. بنابراین فلزها اغلب کاهنده و نافلزها اغلب اکسنده هستند.
نکته:به طور کلی هر چه فلز کاهنده ی قویتری باشد، کاتیون آن اکسنده ی ضعیف تری است.
نکته:در هر واکنش شیمیایی هنگامی که بار الکتریکی یک گونه مثبت تر می شود، آن گونه اکسایش یافته و گونه ای که بار الکتریکی آن منفی تر می شود، کاهش می یابد.
سلول گالوانی
اگر به جای داد و ستد الکترون بین واکنش دهنده ها، بتوان الکترون ها را از طریق یک مدار بیرونی هدایت و جابه جا کرد، می توان بخشی از انرژی در واکنش اکسایش _ کاهش را به انرژی الکتریکی تبدیل کرد.
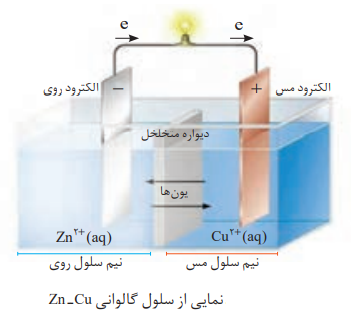
نکته: در نیم سلول، یک رسانای الکترونی(تیغه ی فلزی) در تماس با یک رسانای یونی (محلول الکترولیت) قرار دارد.
نکته: اگر در یک نیم سلول، غلظت کاتیون در محلول الکترولیت M(یک مول بر لیتر) باشد، نیم سلول استاندارد نامیده می شود.
در نیم سلول هایی که واکنش دهنده ی گازی دارند، نیم سلول استاندارد به حالتی گفته می شود که غلظت الکترولیت 1M و فشار گاز 1atm باشد.
از اتصال دو نیم سلول مطابق شکل رو به رو، الکترولیت های آن ها توسط یک دیواره ی متخلخل از هم جدا شده اند، یک سلول گالوانی تشکیل می شود. در یکی از نیم سلول ها نیم واکنش اکسایش و در نیم سلول دیگر نیم واکنش کاهش انجام می شود.
دیواره ی متخلخل امکان جابه جایی یون ها از یک سلول به نیم سلول دیگر را فراهم میکند تا محلول های الکترولیت حالت خنثی خود را حفظ کنند، ولی از مخلوط شدن سریع و مستقیم دو الکترولیت جلوگیری می کند.
توصیحات سلول گالوانی
سلول گالوانی نوعی سلول الکتروشیمیایی است که انرژی شیمیایی را به انرژی الکتریکی تبدیل می کند. در این نوع سلول ها:
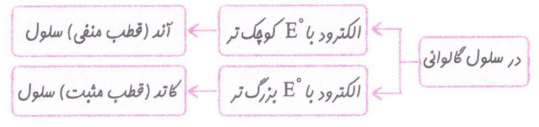
1-الکترودی که نیم واکنش اکسایش در آن صورت می گیرد، آند نامیده می شود.
2-الکترودی که نیم واکنش کاهش در آن صورت می گیرد، کاتد نامیده می شود.
3-جهت حرکت الکترون ها در مدار بیرونی از آند به کاتد است.
4-کاتد قطب مثبت و آند قطب منفی سلول است.
5-الکترولیت های دو نیم سلول توسط یک دیواره ی متخلخل از یکدیگر جدا شده اند.
6-از طریق دیواره ی متخلخل کاتیون ها به سمت کاتد و آنیون ها به سمت آند حرکت می کنند تا حالت خنثی در هر دو نیم سلول حفظ شود.
7-فلز فعال تر آند است.
توجه: دراین واکنش به ازای هر مول فلز 2 مول الکترون مبادله می شود.
در نتیجه ی نیم واکنش اکسایش، تیغه ی آند Zn به تدریج حل شده و کاهش جرم می یابد. از طرفی انتظار می رود غلظت کاتیون روی از آنیون ها بیشتر شود، اما در عمل این اتفاق نمی افتد.
در نتیجه ی نیم واکنش کاهش، تیغه ی کاتد Cu به تدریج افزایش جرم می یابد. از طرفی انتطار می رود غلظت آنیون ها از کاتیون مس بیشتر شود اما در عمل این اتفاق نمی افتد.
دلیل تغییر نکردن غلظت یون ها در محلول آندی و کاتدی این است که کاتیون از نیم سلول آند به کاتد و آنیون ها از نیم سلول کاتد به آند با گذر از دیواره متخلخل مهاجرت می کنند.
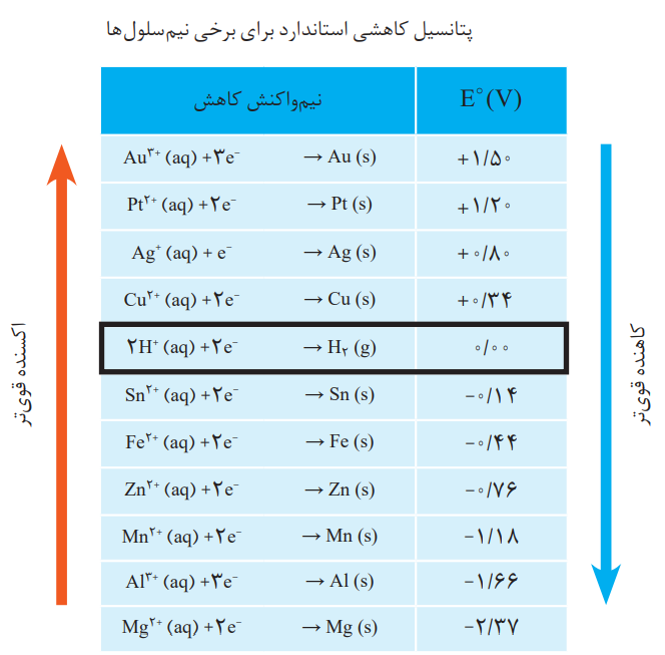
در سری الکتروشیمایی:
نیم واکنش ها به صورت کاهشی نوشته شده و پتانسیل داده شده، تمایل برای کاهش یا قدرت اکسندگی گونه ی سمت چپ در نیم واکنش را نشان می دهد.
این سری دارای نکات زیر است:
1-از بالا به پایین پتانسیل کاهشی کوچکتر می شود.
2-هر چه گونه ای بالاتر باشد، E بزرگتری دارد پس تمایل برای کاهش بیشتر است و اکسنده ی قوی تری است.
3- هر چه گونه ای پایین تر باشد، E کمتری دارد پس اکسنده ضعیف تری است. البته در این حالت گونه ی کاهنده که در سمت راست نیم واکنش نوشته شود، قوی تر است.
4-پتانیسل کاهشی هیدروژن برابر صفر است.
5-پتانسیل کاهشی گونه های بالای هیدروژن مثبت است.
6-پتانسیل کاهشی گونه های پایین هیدروژن منفی است.
emf
همانطور که می دانید، اختلاف پتانسیل تولید شده در یک سلول استاندارد را نیروی الکتروموتوری سلول می گویند و با emf نشان می دهند که با استفاده از رابطه ی زیر به دست می آید:
سلول سوختی
سوخت های فسیلی هم چنان مناسب ترین سوخت برای خودرو ها و نیروگاه ها به شمار می روند و اما باید به فکر جایگزینی مناسب بود. زیرا:
1-ذخایر سوخت های فسیلی به سرعت در حال کاهش است.
2-ذخایر سوخت های فسیلی باعث گسترش روز افزون آلودگی هستند.
یک راه حل مناسب برای عبور از تنگنای تامین انرژی و کاهش آلودگی محیط زیست، استفاده از سلول های سوختی است.
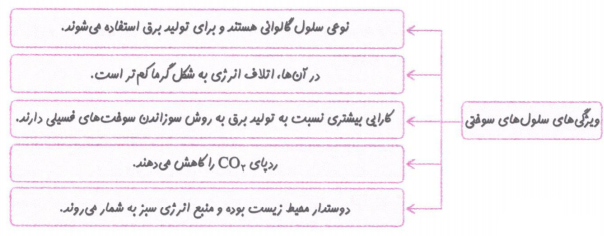
ویژگی های سلول سوختی
1-نوعی سلول گالوانی است که می تواند انرژی شیمیایی واکنش اکسایش _ کاهش مربوط به سوختن گازی را به انرژی الکتریکی تبدیل کند.
2-کارایی بیشتری از موتورهای درون سوز دارد. مثلا سوزاندن هیدروژن در یک موتور درون سوز، بازدهی حدود 20 درصد دارد، در حالی که اکسایش هیدروژن در سلول سوختی بازده راتا 3 برابر (حدود 60 درصد) افزایش می دهد.
3-دوست دار محیط زیست و منبع انرژی سبز به شمار می آید و ردپای کربن دی اکسید را کاهش می دهد.
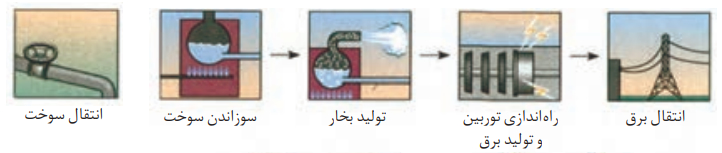
تبدیل انرژی شیمیایی موجود در یک سوخت به انرژی الکتریکی قابل استفاده در یک سلول سوختی، شامل 2 مرحله است:
نکته: تبدیل انرژی سوخت های فسیلی مانند متان به انرژی الکتریکی از طریق سوزاندن، با بازده کمی صورت می گیرد. زیرا بخش عمده ای از انرژی به صورت گرما به محیط اطراف داده می شود و به انرژی الکتریکی تبدیل نمی شوند.
هر سلول سوختی سه جز اصلی دارد:
1) الکترود آند 2) الکترودکاتد 3) یک غشاء
شکل زیر، رایج ترین سلول سوختی، یعنی سلول سوختی هیدروژن – اکسیژن را نشان می دهد.
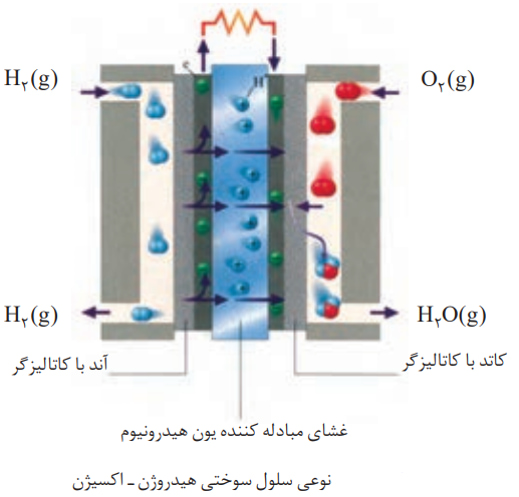
1-گاز هیدروژن وارد قسمت آندی و گاز اکسیژن وارد قسمت کاتدی می شود.
2-آند و کاتد دارای کاتالیزگرهایی هستند که به نیم واکنش های اکسایش و کاهش سرعت می بخشند.
3-پروتون تولید شده در آند از طریق غشاء مبادله کننده ی پروتون به سمت کاتد حرکت کرده و در نیم واکنش کاتدی مصرف می شود.
4-جهت حرکت الکترون ها در مدار بیرونی از آند به کاتد است.
5-سلول های سوختی برخلاف باتری ها انرژی شیمیایی را ذخیره نمی کنند.
6-یکی از چالش های سلول سوختی هیدروژن – اکسیژن، تامین سوخت آن هاست.
جمع بندی
تست های منتخب؛ (تست های زیر را حل کنید و پاسخ آن ها را در کامنت ها به اشتراک بگذارید!)
تست 1

تست 2

تست 3

تست 4

تست 5

تست 6

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


