سلام
در این مطلب میخواهیم با هم به جمع بندی نکات اسید و باز (مطابق با آزمون جامع) و خلاصه نکات که برای پاسخگویی به سوالات آزمون باید به آنها مسلط باشید، بپردازیم.
هر چه غلظت یون هیدرونیوم در محلولی بیشتر باشد، آن محلول اسیدی تر و هر چه غلظت یون هیدرکسید در محلولی بیشتر باشد، آن محلول بازی تر است.
هم چنین اگر در یک سامانه غلظت یون هیدرونیوم و هیدروکسید با هم برابر باشد، آن سامانه حالت خنثی دارد.
یونش
به فرآیندی که در آن یک ترکیب مولکولی در آب به یون های مثبت و منفی تبدیل می شود، یونش می گویند.
اسیدهای قوی
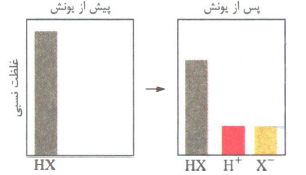
با حل شدن در آب، تقریبا به طور کامل یونش می یابند؛ یعنی تقریبا همه مولکول های اسید در آب یونیده می شوند. غلظت هر یک از یون ها در محلول اسیدهای قوی تک پروتون دار با غلظت اولیه اسید برابر است و پس از یونش، خبری از اسید اولیه به صورت مولکولی نیست.
محلول اسیدهای قوی را می توان محلولی شامل یون های آبپوشیده دانست؛ به طوری که در آن ها تقریبا مولکول های پونیده نشده وجود ندارد. HI ،HBr ،HCl و HNO از جمله اسیدهای قوی هستند. غلظت نسبی گونه های موجود در محلول اسیدهای قوی تک پروتون دار را می توان به صورت زیر نشان داد:

اسیدهای ضعیف
با حل شدن در آب به طور جزئی یونش می یابند؛ یعنی تعداد کمی از مولکولهای اسیدبه یون تبدیل می شوند و در محلول، علاوه بر یون های آبپوشیده، مولکول های اسید نیز وجود دارند. معادله یونش اسیدهای ضعیف در آب را به صورت دوطرفه (برگشت پذیر) نشان می دهیم:
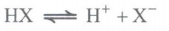
اسید تک پروتون دار
به اسیدی که هر مولکول آن در آب تنها یک یون هیدرونیوم تولید می کند، اسید تک پروتون دار گویند.
در کربوکسیلیک اسیدها تنها هیدروژن گروه کربوکسیل آن ها می تواند به صورت یون هیدرونیوم وارد محلول شود.
تعادل
اگه یادتون باشه ! گفتیم که در محلول اسیدهای ضعیف، یون های آبپوشیده به طور همزمان با مولکول های اسید یونیده نشده حضور دارند؛ به طوری که در شرایط معین، غلظت همه گونه های موجود در محلول، ثابت است. حضور همزمان یون ها و مولکول های یونیده نشده باغلظت ثابت در محلول نشان میدهد که محلول اسیدهای ضعیف در آب یک سامانه تعادلی است. حالا ببینیم تعادل یعنی چی؟! در شیمی دهم خواندیم که به واکنش هایی که می توانند در هر دو جهت رفت (تبدیل واکنش دهنده ها به فراورده ها) و برگشت (تبدیل فراورده هابه واکنش دهنده ها) انجام شوند، واکنش های برگشت پذیر می گویند. اگر این واکنش هادر شرایط مناسبی انجام شوند، سرانجام لحظه ای فرا می رسد که سرعت واکنش رفت باسرعت واکنش برگشت برابر می شود. در این لحظه، غلظت واکنش دهنده ها و فراورده ها ثابت می ماند؛ به طوری که همان مقدار از واکنش دهنده ها که در واحد زمان طی واکنش رفت مصرف می شوند، در اثر واکنش برگشت، دوباره تولید می شوند. به همین ترتیب همان مقدار از فراورده ها که در یک واحد زمان طی واکنش رفت تولید می شوند، در اثر واکنش برگشت مصرف می شوند. در این حالت می گوییم واکنش به تعادل رسیده است.
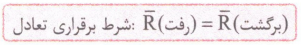
1- هر دو واکنش رفت و برگشت در هنگام تعادل با سرعت برابر انجام می شوند؛ یعنی همواره تبدیل مواد به یکدیگر در حال انجام شدن است. حواستون باشه که در هنگام تعادل، مقدار یا غلظت واکنش دهنده ها و فراورده ها لزوما با هم برابر نیست و فقط می توان گفت که غلظت مواد ثابت می ماند.
۲- همه واکنش های تعادلی، برگشت پذیرند، اما هر واکنش برگشت پذیری، تعادلی نیست. برای برقراری تعادل، سامانه نباید با محیط، مبادله ماده داشته باشد.
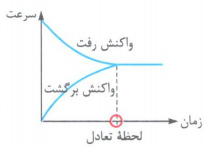
3- اگر فرض کنیم که در ابتدا، فقط واکنش دهنده ها در ظرف واکنش وجود داشته باشند، نمودار «سرعت - زمان» یک واکنش تعادلی را می توان به صورت روبه رو نشان داد:
واکنش برگشت ناپذیر
به واکنشی گفته می شود که واکنش دهنده ها به فرآورده ها تبدیل شوند. اما فرآورده ها نمی توانند به واکنش دهنده ها تبدیل شوند. مانند سوختن مواد آلی یا واکنش فلزهای قلیایی با آب.
نکته: همه ی واکنش های گرماده که شمار مول های گازی فرآورده بیشتر از شمار مول های واکنش دهنده باشد، برگشت ناپذیر هستند.
نکته: در یک واکنش شیمایی اگر q (گرما) در طرفی باشد که تعداد مول های گازی کمتر است، واکنش برگشت پذیر می باشد.
نکته: واکنش های رفت و برگشت در سامانه های تعادلی به طور پیوسته و با سرعت برابر انجام می شوند و به همین دلیل مقدار مواد در واکنش ثابت می ماند.
نکته: تا قبل از برقراری تعادل در یک واکنش برگشت پذیر، خواصی مانند غلظت، جرم، حجم، فشار و رنگ تغییر می کند، اما زمانی که تعادل برقرار شد، غلظت و سایر خواص ثابت می مانند و تغییر نمی کنند. در هنگام تعادل سرعت تولید هر ماده با سرعت مصرف آن ماده برابر است.
نکته: مقدار تغییر غلظت هر ماده بستگی به ضریب استوکیومتری آن ماده در معادله ی موازنه شده ی واکنش دارد. در ضمن غلظت واکنش دهنده ها در واکنش های تعادلی به صفر نمی رسد.
نکته: تنها عامل موثر بر ثابت تعادل فقط دماست و با تغییر غلظت،تغییر فشار، تغییر حجم ظرف واکنش و یا به کار بردن کاتالیزگر، مقدار ثابت تعادل (K) تغییر نمی کند.
مقدار K برای یک واکنش تعادلی در دمای معین، مقدار ثابتی است.
مقدار K در دمای ثابت به مقدار اولیه ی واکنش دهنده ها و فرآورده ها بستگی ندارد.
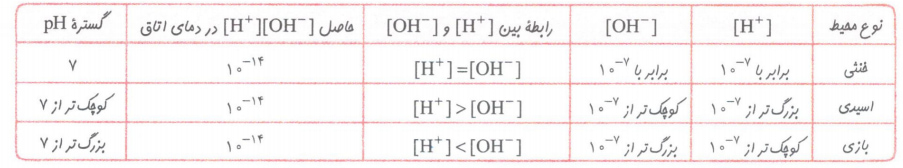
نکته: ثابت تعادل یونش آب فقط به دما بستگی دارد و با اضافه کردن اسید یا باز تغییر نمی کند.
نکته: در اسیدهای ضعیف تک پروتون دار، غلظت یون هیدرونیوم برابر حاصل ضرب مولاریته ی اسید در درجه ی یونش است.
تست های منتخب؛ (تست های زیر را حل کنید و پاسخ آن ها را در کامنت ها به اشتراک بگذارید!)
تست 1

تست 2

تست 3

تست 4

تست 5

تست 6

تست 7

تست 8

دوستان عزیز می توانید برای دسترسی به نسخه کامل خلاصه نکات به همراه پاسخ فایل پی دی اف زیر را دانلود کنید!
فراموش نکنید اگر سوالی در رابطه با این مبحث داشتید می توانید به راحتی در کامنت ها سوال خود را برای ما بنویسید.
دوستان عزیزم ما تصمیم گرفتیم برای اینکه بتونیم ارتباطمون رو با هم بیشتر کنیم و قدم به قدم کنارتون باشیم، صفحه ی اینستاگرام متا رو بسازیم
و همراهتون باشیم.
با آرزوی موفقیت و کامیابی
گلنوش بیرانوند، دانشجوی مهندسی شیمی دانشگاه شریف
نوید آرمات، دانشجوی مهندسی عمران دانشگاه تهران


