|
|||||||||||
|
نام ماده: |
اتن(Ethen) |
||||||||||
|
نام تجاري: |
اتيلن(Ethylene) |
||||||||||
|
ساير اسامي: |
بيکربورات هيدروژن , اتن , اتيلن مايع , گاز الفيتات |
||||||||||
|
تاريخچه: |
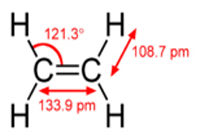
اتيلن، ساده ترين هيدروکربن غير اشباع بوده و اولين عضو از گروه آلکنها ميباشد. فرمول شيميايي آن C2H4 بوده، بين دو اتم کربن پيوند دوگانه وجود دارد. به دليل وجود اين پيوند دوگانه، اتيلن ايزومر صورتبندي ندارد، يعني دو نيمه مولکول نميتوانند با چرخش حول پيوند دوگانه، صورتبندي خود را تغيير دهند. اتيلن داراي ساختمان مسطح بوده، زاويه بين دو اتصال کربن-هيدروژن، 117 درجه ميباشد. يعني مقداري بستهتر از زاويه 120 درجه که براي هيبريداسيون sp2 مناسب ميباشد. اتيلن گازي بيرنگ و آتش گير بشمار ميرود و در ترکيب نفت و گاز طبيعي يافت ميشود. در سال 1795، اتيلن را گاز اولفين ميناميدند. اولين سنتز ترکيبات اتيلن (دي کلرو اتان) در سال 1795 توسط شيميدان هلندي انجام شد. در اواسط قرن 19 به علت اينکه C2H4 يک هيدروژن از C2H5 اتيل کم داشت، پسوندهاي ene (از ريشه يوناني) به آخر اتيل اضافه کرده و از آن به بعد گاز اولفين را اتيلن مينامند. تا سال 1852 در متون علمي واژه اتيلن استفاده ميشد. در سال 1866 "هافمن" شيميدان آلماني ، سيستم نامگذاري هيدروکربنها را بر پايه آلکان بنا نهاد. در اين سيستم، هر هيدروکربني که از آلکان مربوطه دو هيدروژن کمتر داشت، آلکن با فرمولCnH2n و اگر چهار هيدروژن از آلکان مربوطه کم داشت آلکين CnHn ناميده ميشود. طبق اين نامگذاري، اتيلن به اتن تغيير نام يافت. انجمن بين المللي شيميدانها در سال 1892 اين نام را وارد نامگذاري IUPAC کردند و از آن تاريخ تا امروز، اين نام در متون علمي و کتابهاي درسي و ... مورد استفاده قرار ميگيرد. جرم مولکولي اين ترکيب 05/28 گرم بر مول ودانسيته آن 26/1 گرم برليتر ميباشد. قابليت انحلال آن 250mg در يک ليترآب صفر درجه است. نقطه ذوب آن 41.04 کلوين و نقطه جوش آن 169.4و حد انفجارش 7/2 تا 36% در هواست. |
||||||||||
|
موارد مصرف: |
اتيلن ماده اوليه مهم براي توليد بسياري از ترکيبات آلي پر مصرف در صنعت بشمار ميرود. اتيلن به صورت گسترده در صنعت پلاستيک مورد استفاده قرار ميگيرد. اتيلن با پليمريزه شدن، پلي اتيلن را توليد ميکند که يک پلاستيک بسيار مهم است. با تکرار شدن، پيش ماده پلي وينيل کلريد (PVC) را توليد ميکند. با ترکيب شدن بنزن، اتيل بنزن ايجاد ميکند که ماده اصلي پلي استر ميباشد. اتيلن ، نوعي هورمون گياهي است که باعث رسيدن ميوهها ، باز شدن شکوفهها و گلها و همچنين ريزش برگها در پاييز ميشود. به دليل اين خاصيت در کشاورزي مورد استفاده قرار ميگيرد. براي جلوگيري از خراب شدن ميوههايي مانند سيب، گلابي و موز، در حمل و نقل يا انبار، آنها را کمي نارس ميچينند و قبل از وارد کردن به بازار، تحت تأثير اتيلن قرار ميدهند تا رسيده شود. توليد پلي اتيلن ، اتيلن اکسايد ، اتيلن دي کلرايد ، اتيلن گلايکول ، وينيل کلرايد ، استالدئيد از مهمترين کاربردهاي اتيلن است. |
||||||||||
|
مجتمع هاي توليدکننده: |
پتروشيمي اميرکبير پتروشيمي بندرامام |
||||||||||
|
خواص فيزيکي و شيميايي: |
Molecular formula: C2H4 Molar mass: 28.05 g/mol Appearance colourless gas Density 1.178 kg/m3 at 15 °C, Melting point: -169.2 °C (104.0 K, -272.6 °F) Boiling point -103.7 °C (169.5 K, -154.7 °F) Solubility in water 3.5 mg/100 ml (17 °C) Acidity (pKa) 44 Structure Molecular shape D2h Dipole moment zero | ||||||||||
مواد مرتبط: |
پلي اتيلن |
||||||||||
|
روشهاي توليد: |
اتيلن در صنايع پتروشيمي با روش کراکينگ با بخار آب توليد ميشود. در اين فرآيند هيدروکربنهاي گازي و محلولهاي سبک هيدروکربن حاصل از نفت به مدت بسيار کوتاه در دماي 950 - 750 درجه سانتيگراد حرارت داده ميشوند. عموماً در اين واکنش هيدروکربنهاي بزرگ به هيدروکربنهاي کوچک شکسته شده، هيدروکربنهاي اشباع با از دست دادن هيدروژن به هيدروکربنهاي غير اشباع تبديل ميشوند. محصول اين واکنش مخلوطي از انواع هيدروکربنهاست که اتيلن عمده ترين آن ميباشد. مخلوط را بهوسيله متراکم سازي و تقطير جز به جز جداسازي ميکنند. روشهاي ديگر، هيدروژندار کردن استيلن با استفاده از کاتاليزور و آبگيري از اتانول ميباشد. |
||||||||||
|
دياگرام فرآيند (PFD): |
 |
||||||||||
|
واکنشهاي شيميايي: |
آلکنها به علت داشتن پيوند دوگانه در واکنشهاي افزايشي شرکت ميکنند. هالوژنها با اتيلن واکنش داده و توليد هالو اتان ميکند. با افزودن آب به پيوند دوگانه اتانول توليد ميشود، اما سرعت واکنش بدون حضور کاتاليزگر پايين ميباشد. در حضور کاتاليزگرهاي فلزي نظير پلاتين، نيکل و ... و فشار بالا، اتيلن، هيدروژندار شده، به اتان تبديل ميشود. اتيلن در حضور پراسيدها به اتواکسيد که يک ترکيب حلقوي است تبديل ميشود. اتيلن در حضور راديکالهايي که واکنش بسپارش را آغاز ميکنند، به پلي اتيلن پليمريزه ميشود. |
||||||||||
|
اطلاعات ايمني: |
اتيلن تحريک کننده پوست و چشم نيست ولي تماس با اتيلن مايع ممکن است سبب يخ زدگي شديد شود. اتيلن بشدت اشتعال پذير است. |
||||||||||